
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
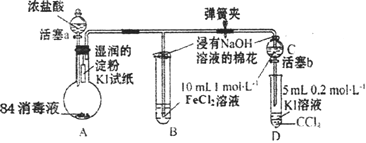
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式________。
(2)验证氯气的氧化性强于碘单质的实验现象是________。
(3)B中溶液发生反应的离子方程式是________。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是________,对应反应的离子方程式是________。
(5)浸有氢氧化钠溶液的棉花作用是________。
(6)过程Ⅲ实验的目的是________。
【答案】 2H++Cl-+ClO-=Cl2↑+H2O 淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- 打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡。静置后CCl4层溶液变为紫色 2I-+2Fe3+=2Fe2++I2 吸收氯气等有毒气体,防止污染空气 确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰
【解析】试题分析:本题考查Cl2、Fe3+、I2的氧化性强弱的实验探究,涉及实验的分析、Cl2的制备、实验现象的描述、离子方程式的书写。
(1)84消毒液的有效成分为NaClO,向84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O。
(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI试纸变蓝,发生反应的化学方程式为Cl2+2KI=2KCl+I2。
(3)B中的溶液变为黄色,B中反应为Cl2将Fe2+氧化成Fe3+,B中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+。
(4)要验证Fe3+的氧化性强于I2,依据的反应原理为2Fe3++2I-=I2+2Fe2+;过程II的C中溶液变为黄色说明C中FeCl2被氧化成FeCl3,所以验证Fe3+的氧化性强于I2,过程IV的操作是:打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡;实验现象是:静置后CCl4层溶液变为紫色。反应的离子方程式为2Fe3++2I-=I2+2Fe2+。
(5)由于Cl2有毒,污染大气,浸有NaOH溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(6)由于氯气也能将KI氧化成I2,要验证Fe3+的氧化性强于I2必须排除Cl2的干扰,即必须确认C的黄色溶液中无Cl2。过程III向B中加入一定量KSCN溶液,混合液呈红色说明B中FeCl2被氧化成FeCl3;一段时间后B中红色加深说明过程II的B中FeCl2未被完全氧化,则过程II的C中FeCl2未被完全氧化、黄色溶液中没有Cl2;过程III的实验目的是:确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如右图的装置,对此,下列有关电源电极名称和消毒液的主要成分的判断正确的是()。 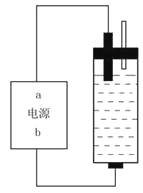
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
D.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在化学中有广泛的运用,比如可以用酸性高锰酸钾溶液来测定双氧水的浓度。已知该反应中MnO4-只发生如下过程:MnO4-→Mn2+
(1)该反应中还原剂是_________________;
(2)写出该反应的离子方程式________________________________;
(3)如果反应中转移了0.5mol电子,则产生的气体在标准状况下的体积为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.试回答下列问题:
(1)A点时,白色固体M的化学式为 , 通入的CO2的体积为mL(标准状况下,下同).
(2)C点时,白色固体M的化学式为 , 通入的CO2的体积为mL.
(3)B点时M的组成成分为(用化学式表示),通入的CO2的体积为mL.
(4)该NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A.在标准状况下,22.4 L C2H6中含共价键的数目为6 NA
B.5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA
C.常温下,1 L 0.1 mol·L–1 CH3COONa溶液中CH3COO-离子数目为0.1 NA
D.在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有以下物质相互转化,其中B溶液为浅绿色,I溶液为棕黄色,J为AgCl,请回答:

(1)C是(填化学式)_____,F的化学式_____.
(2)写出B的化学式______,检验B中阳离子的操作方法是__________________.(只填一种方法,用文字表述)
(3)写出由G转变成H的化学方程式_______________________.
(4)写出检验I溶液中阳离子的离子方程式________________;向I溶液中加入单质Cu的有关离子反应方程式是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
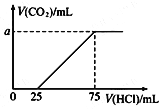
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com