
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
 C6H5COOCH3+H218O.
C6H5COOCH3+H218O.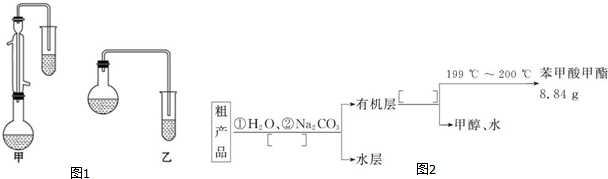
分析 Ⅰ.(1)反应为酯化反应,浓硫酸起到吸水、催化作用;
(2)酯化反应机理为酸脱羟基醇脱氢,据此写出该反应的化学方程式;
(3)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
(4)甲醇过量,有利于使平衡正向移动;
Ⅱ.(5)操作①用于分离有机物层和溶液,操作②用于分离沸点不同的物质;
(6)根据反应物的物质的量判断过量,根据不足量计算出理论上生成苯甲酸甲酯的物质的量,再计算出其产率.
解答 解:(1)浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用,
故答案为:催化剂、吸水剂;
(2)苯甲酸与甲醇在浓硫酸作用下的酯化反应为:苯甲酸脱去羟基,据此脱去羟基中的氢原子,二者反应生成苯甲酸甲酯,所以水中18O原子来自苯甲酸,反应的化学方程式为:C6H5CO18OH+CH3OH C6H5COOCH3+H218O,
C6H5COOCH3+H218O,
故答案为:C6H5CO18OH+CH3OH C6H5COOCH3+H218O;
C6H5COOCH3+H218O;
(3)由装置图可知,甲图的圆底烧瓶上有冷凝管,充分起到回流作用,乙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用乙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:甲;甲中有冷凝回流装置;
(4)由于该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高苯甲酸甲酯的产率,
故答案为:反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率;
(5)苯甲酸甲酯不溶于水,操作Ⅰ分离出互不相溶的液体,通常采用分液操作完成;甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,
故答案为:分液、蒸馏;
(6)12.2g苯甲酸的物质的量为:$\frac{12.2g}{122g/mol}$=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol>0.1mol,
则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%.
点评 本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,为高考常见题型,题目难度中等,明确物质的制备原理为解答此类题的关键,该题为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 ; F的化学式FeCl2.
; F的化学式FeCl2. .反应②:
.反应②: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 | |
| B. | Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 | |
| C. | Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 | |
| D. | NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
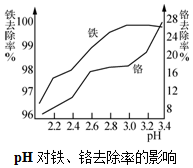 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
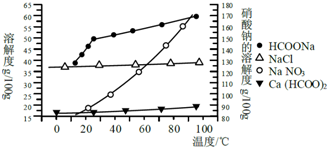
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
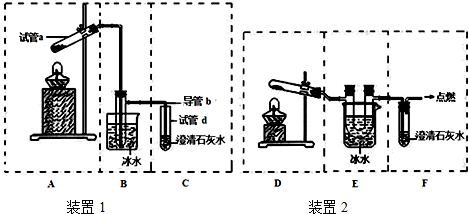
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com