
 ʵ������Ҫ0.80mol?L-1 NaOH��Һ475mL��0.40mol?L-1����500mL��������������Һ����������ش��������⣺
ʵ������Ҫ0.80mol?L-1 NaOH��Һ475mL��0.40mol?L-1����500mL��������������Һ����������ش��������⣺| n |
| V |
| 100�Ѧ� |
| M |
| n |
| V |
| 100�Ѧ� |
| M |
| 1000��1.84g?cm-3��98% |
| 98g/mol |


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | ���� | ���� | |
| A | ʳ����ˮ�� | ������ɫ���� | ��������Ա�̼��ǿ |
| B | �Ҵ����ɫ�����ظ������Һ��� | ��ɫ��Һ��Ϊ��ɫ | �Ҵ����л�ԭ�� |
| C | ��Ƶε�����Ƭ�� | ����Ƭ���� | ��������Ԫ�ر��� |
| D | ����Cu��OH��2����������Һ��ϼ��� | ������ɫ���� | �����Ǿ��л�ԭ�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ܷ���������Ӧ����̼��� |
| B��̼������ᶼ����Ӧ�����ﶼ�������Ե��� |
| C������������ˮ����ˮ�е��ܽ�Ƚϴ�̼����ܽ�Ƚ�С |
| D��������������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
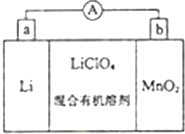 ��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺
��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| V(Cl2) |
| V(CH4) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �̷� |
| H |
| ʯ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com