
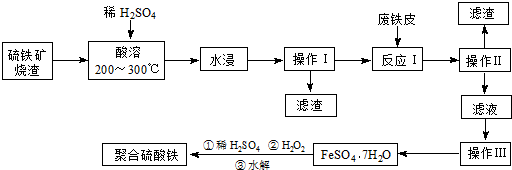
分析 硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁,(1)操作I为过滤,根据过滤操作分析;
(2)硫铁矿烧渣在“酸溶”前要粉碎可增大固体的接触面积;“酸溶”后的溶液中含有Fe3+和Fe2+,检验Fe2+试剂是KMnO4 溶液,现象是紫红色褪去;
(3)操作Ⅲ的目的是由溶液得到晶体FeSO4•7H2O,需蒸发浓缩、冷却结晶.洗涤的操作方法是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2-3次;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时生成水.
解答 解:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁,
(1)根据流程图可知,操作I为过滤,需要的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗;
(2)硫铁矿烧渣在“酸溶”前要粉碎可增大固体的接触面积,以加快反应速率,“酸溶”后的溶液中含有Fe3+和Fe2+,Fe2+具有还原性,所以检验Fe2+试剂是KMnO4 溶液,现象是紫红色褪去,
故答案为:增大烧渣与硫酸的接触面积,加快烧渣的溶解速率;酸性KMnO4溶液,紫色褪去;
(3)操作Ⅲ的目的是由溶液得到晶体FeSO4•7H2O,需蒸发浓缩、冷却结晶,洗涤的操作方法是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2-3次,
故答案为:蒸发浓缩(加热浓缩);沿玻璃棒向漏斗里加入蒸馏水,使水没过沉淀物,等水自然流下后,重复操作2~3次;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查制备实验方案的设计与评价,题目难度中等,准确的分析流程、明确铁及其化合物的性质是解题的关键,侧重学生分析能力和创新能力的培养.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2溶液 | B. | Ba(NO3)2溶液 | C. | 浓溴水 | D. | 饱和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
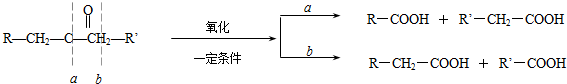
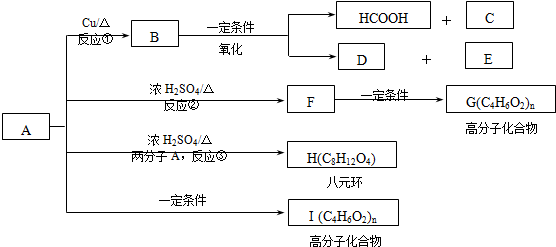
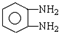 )生成一种合成纤维:
)生成一种合成纤维: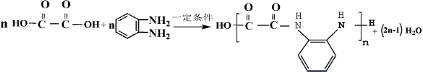 .
.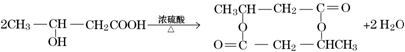 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )
对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )| A. | 电解时Pt电极应与直流电源的负极相连 | |
| B. | 电解时Pt电极上有H2放出 | |
| C. | 阴极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O | |
| D. | 电解一段时间后,硫酸溶液的pH不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com