
【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。

(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。
【答案】Mg(OH)2 能安静燃烧、产生淡蓝色火焰,气体成分为氢气 稀盐酸(合理均可) 产生气泡,沉淀全部溶解 CO32— 3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3] NaHCO3溶液中存在如下平衡:HCO3—![]() H++CO32—、H2O
H++CO32—、H2O![]() H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均向右移动。故Mg与饱和NaHCO3溶液反应产生大量H2
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均向右移动。故Mg与饱和NaHCO3溶液反应产生大量H2
【解析】
本题考查常见离子的检验方法和实验现象的记忆,从质量守恒定律角度进行计算及影响电离、水解平衡的因素。
(1)依据猜测可知白色不溶物不可能是MgCO3或xMgCO3·yMg(OH)2,联想可得猜测1为Mg(OH)2;
(2)迅速反应,产生大量气泡和白色不溶物,说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色沉淀;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子,故答案为:能安静燃烧、产生淡蓝色火焰,该气体为氢气;稀盐酸;产生气泡,沉淀全部溶解;CO32-。
(3)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设生成2.64g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X2.64g
解得X=5.04g,所以含有氢氧化镁质量为:6.20g-5.04g=1.16g;
碳酸镁和氢氧化镁物质的量之比为:![]() :
:![]() =3:1,故化学式为3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]。
=3:1,故化学式为3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]。
(4)HCO3—存在电离平衡和水解平衡:HCO3—![]() H++CO32—、HCO3—+H2O
H++CO32—、HCO3—+H2O![]() H2CO3+OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均正向移动。故Mg与饱和NaHCO3溶液反应产生大量H2
H2CO3+OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—生成难溶物Mg(OH)2·3MgCO3,则H+、OH-、CO32—的浓度均降低,促使上述两平衡均正向移动。故Mg与饱和NaHCO3溶液反应产生大量H2


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB![]() pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
A. 若增加B的量,平衡体系颜色加深,说明B必是气体
B. 增大压强,平衡不移动,说明m+n一定等于p+q
C. 升高温度,A的转化率减小,说明正反应是吸热反应
D. 若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是

A. NH4Cl的电离方程式为:NH4Cl![]() Cl-+NH4+
Cl-+NH4+
B. M点时,pH≈9
C. a=0.05
D. 当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.“碳纳米泡沫”被称为第五形态的单质碳,它与石墨互为同素异形体
B.分子组成相差一个或若干个CH2原子团的物质,彼此一定互为同系物
C.宇宙中新发现的H3分子与H2分子互为同位素
D.![]() 和
和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学兴趣小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了如下回收镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是___________________________________。为达到目的,还可以采取的措施是_________________________________________________(任写一条)。
(2)酸浸时,生成滤渣1的离子方程式为__________________________________。
(3)第一次调节pH的目的是_____________________________。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为__________________。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Mg(OH)2]=1.8×10-11。
(4)设计简单方案分离滤渣2中的成分,简述实验过程:________________________________。
(5)滤液3中可回收利用的物质主要是__________(写化学式),其阳离子的电子式为________。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是
2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是

A. 2SO2(g) +O2(g) ![]() 2SO3(1) △H>-a kJ/mol
2SO3(1) △H>-a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 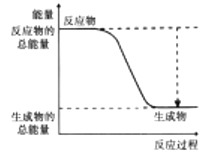 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com