
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分PH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
(1)依据题意判断,T℃ 大于 25℃(填“大于”、“小于”或“等于”)
(2)b= 4 ,X= 27
(3)反应③的离子方程式为: Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH﹣) 1:20 .
| 酸碱混合时的定性判断及有关ph的计算. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,a+b=12,c(H+).c(OH﹣)=10﹣12mol/L, (1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大; (2)该温度下,溶液的pH=6时呈中性,①中溶液的pH=8,则Ba(OH)2稀溶液中 pH=7>6,说明溶液呈碱性,则溶液中 (3)反应③中氢离子和氢氧根离子恰好反应且同时生成硫酸钠、硫酸钡; (4)此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+)是原来的 |
| 解答: | 解:温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,a+b=12,c(H+).c(OH﹣)=10﹣12mol/L, (1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,该温度下c(H+).c(OH﹣)=10﹣12mol/L>10﹣14mol/L,所以该温度大于25℃,故答案为:大于; (2)该温度下,溶液的pH=6时呈中性,①中溶液的pH=8,则Ba(OH)2稀溶液中c(OH﹣)= pH=7>6,说明溶液呈碱性,则溶液中 混合溶液中 故答案为,4;27; (3)反应③中氢离子和氢氧根离子恰好反应且同时生成硫酸钠、硫酸钡,离子方程式为Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,故答案为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O; (4)此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+)是原来的 |
| 点评: | 本题考查酸碱混合溶液定性判断及溶液pH的计算,正确计算氢氧化钡和硫酸氢钠溶液的物质的量浓度是解本题关键,注意酸或碱稀释接近中性时要考虑水的电离,为易错点,题目难度中等. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
一定条件下,2SO2(g)+O2(g) 2SO3(g) △H<0,有关叙述正确的是
2SO3(g) △H<0,有关叙述正确的是
A.升高温度,v(正)变大,v(逆)变小
B.恒温恒容,充人O2,02的转化率升高
C.恒温恒压,充人N2,平衡不移动
D.恒温恒容,平衡前后混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作和说法正确的是( )
|
| A. | 用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
|
| B. | 润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
|
| C. | 用瓷坩埚加热熔化碳酸钠固体 |
|
| D. | Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
|
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
|
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
|
| C. | 丙中含有二周期IVA族的元素,则丙一定是甲烷的同系物 |
|
| D. | 丁和甲中各元素质量比相同,则丁中一定含有﹣1价的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的下列叙述,正确的是( )

|
| A. | 电流方向是从锌片经导线流向铜片 |
|
| B. | 锌是阳极,锌片上有大量气泡产生 |
|
| C. | 铜离子在铜片表面被氧化,质量逐渐增大 |
|
| D. | 盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 Mg2Mo3S4,下列说法不正确的是( )
Mg2Mo3S4,下列说法不正确的是( )
|
| A. | 放电时,Mo3S4发生氧化反应 |
|
| B. | 放电时,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣ |
|
| C. | 充电时,Mg2+向阴极迁移 |
|
| D. | 充电时,阴极反应式:xMg2++2xe﹣→xMg |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据有机物的命名原则,下列命名正确的是( )
|
| A. |
|
|
| B. | CH3CH(C2H5)CH2CH2CH3 2﹣乙基戊烷 |
|
| C. | CH3CH(NH2)CH2COOH α﹣氨基丁酸 |
|
| D. | 3,3﹣二甲基﹣2﹣丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
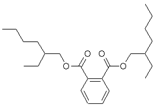
早在2011年6月1日卫生部就紧急发布公告,将塑化剂列入食品中可能
违法添加的非食用物质和易滥用的食品添加剂名单。但近期号称天下第一
酒的酒鬼酒被曝塑化剂含量超标高达260%,可影响发育和导致肝癌。已知塑化剂DEHP分子结构如右图。下列说法中不正确的是 ( )
A.DEHP的化学式为:C24H38O4
B.DEHP是酯类物质,难溶于水
C.DEHP与氢氧化钠溶液共热再酸化可得三种有机产物
D.DEHP不可使溴水因发生化学反应而褪色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com