
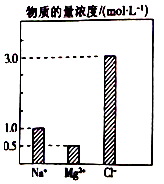
 在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )| A. | NaCl的物质的量为0.2mol | |
| B. | 溶质MgCl2的质量为9 g | |
| C. | 该混合液中BaCl2的物质的量为0.1mol | |
| D. | 将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为0.1mol/L |
分析 由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.2L×1.0mol/L=0.2mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.2L×0.5mol/L×95g/mol=9.5g,由电荷守恒可知2c(Ba2+)+c(Na+)+2c(Mg2+)=c(Cl-),解得:c(Ba2+)=$\frac{3mol/L-1mol/L-0.5mol/L×2}{2}$=0.5mol/L,由此分析解答.
解答 解:A、由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.2L×1.0mol/L=0.2mol,故A正确;
B、c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.2L×0.5mol/L×95g/mol=9.5g,而不是9 g,故B错误;
C、电荷守恒可知2c(Ba2+)+c(Na+)+2c(Mg2+)=c(Cl-),解得:c(Ba2+)=$\frac{3mol/L-1mol/L-0.5mol/L×2}{2}$=0.5mol/L,物质的量为:0.5mol/L×0.2L=0.1mol,故C正确;
D、将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为$\frac{0.1mol}{1L}$=0.1mol/L,故D正确;
故选B.
点评 本题考查了物质的量、物质的量浓度的计算,题目浓度中等,明确稀释过程中溶质的物质的量不变及电荷守恒的应用方法为解答关键,注意熟练掌握物质的量浓度概念及计算方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
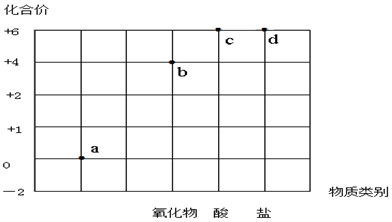
| A. | a点表示的物质所属的物质类别是单质 | |
| B. | b点表示的物质可以是SO2或SO3 | |
| C. | c点表示的化合物的浓溶液可作为干燥剂 | |
| D. | d点表示的可溶性物质能与BaCl2溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的水中水分子数为0.5NA | |
| B. | 通常状况下,0.5NA个氮分子占有的体积为11.2L | |
| C. | 1molH2和O2的混合气体中含2NA个分子 | |
| D. | 0.1mol的OH-中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
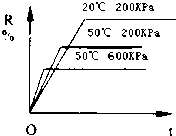 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )| A. | 正反应为放热反应,L为气体 | B. | 正反应为吸热反应,L为气体 | ||
| C. | 正反应为吸热反应,L为固体或液体 | D. | 正反应为放热反应,L为固体或液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com