
| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(OH-)+c(B+) | |
| B. | 若将0.1 mol•L-1 BOH溶液稀释至0.001 mol•L-1则溶液的pH=9 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比1:1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-) |
分析 25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11,则HA溶液中c(H+)=c(HA),所以HA是强电解质,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L<c(BOH),则BOH是弱碱,
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.BOH是弱电解质,加水稀释促进BOH电离;
C.混合溶液pH=7,说明c(H+)=c(OH-),根据电荷守恒判断c(A-)、c(B+)相对大小;
D.若将上述两溶液按体积比1:1混合,二者恰好反应生成强酸弱碱盐BA,溶液呈酸性,再结合电荷守恒判断.
解答 解:25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11,则HA溶液中c(H+)=c(HA),所以HA是强电解质,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L<c(BOH),则BOH是弱碱,
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(A-)+c(OH-)=c(H+)+c(B+),溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(A-)>c(B+),所以c(A-)+c(H+)>c(OH-)+c(B+),故A错误;
B.BOH是弱电解质,加水稀释促进BOH电离,所以若将0.1 mol•L-1 BOH溶液稀释至0.001 mol•L-1,稀释后溶液氢离子浓度大于原来的$\frac{1}{100}$,所以稀释后溶液的11>pH>9,故B错误;
C.混合溶液pH=7,说明c(H+)=c(OH-),根据电荷守恒得c(A-)=c(B+),故C错误;
D.若将上述两溶液按体积比1:1混合,二者恰好反应生成强酸弱碱盐BA,溶液呈酸性,c(H+)>c(OH-),结合电荷守恒得c(A-)>c(B+),所以得c(A-)>c(B+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确判断酸碱强弱是解本题关键,注意电荷守恒的灵活运用,易错选项是A,注意A中不是电荷守恒.


科目:高中化学 来源: 题型:解答题
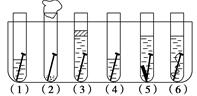 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2CO3?2H++CO32 | ||
| C. | NaHSO4═Na++HSO4- | D. | CH3COOH?H++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为75% | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 采集某雨水样品,放置一段时间,pH由4.8变为4.2,是因为水中溶解了较多的CO2 | |
| D. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
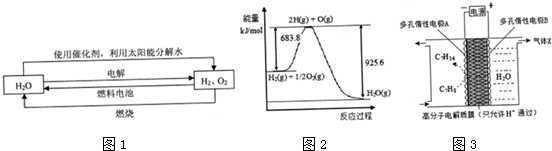
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和同体积同浓度的HAc和HCl,所需碱的物质的量是相同的 | |
| B. | 由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值=2:1 | |
| C. | 某弱酸溶液越稀,其电离度越大 | |
| D. | 强电解质溶液无离解常数,但可以有溶度积常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
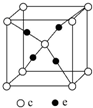 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com