
 请回答下列问题:
请回答下列问题:| 化学键 | H-H | O═O | O-H |
| E/kJ•mol-1 | 436 | x | 463 |
分析 (1)根据焓变△H=反应物的键能总和-生成物的键能总和可计算出x数值;
(2)充电时,阴极上硫酸铅得电子生成铅和硫酸根离子;
(3)①根据影响化学平衡因素结合速率大小分析判断反应前后的体积变化;
②反应前后系数相同,改变压强平衡移动说明反应物中含有固体或纯液体;
③若升高温度,平衡向吸热反应的方向移动;
(4)由反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)可知,Zn元素化合价升高,被氧化,Cu元素化合价降低,被还原,形成原电池知识时,Zn为负极,由图中电子移动方向可知,①为Zn,②为Cu,③为硫酸锌溶液,④为硫酸铜溶液,以此解答该题.
解答 解:(1)根据焓变△H=反应物的键能总和-生成物的键能总和可得:436+$\frac{x}{2}$-463×2=-241.8,求得x=496.4,
故答案为:496.4;
(2)充电时,阴极上硫酸铅得电子生成铅和硫酸根离子,电极反应式为PbSO4+2e-═Pb+SO42-,故答案为:PbSO4+2e-═Pb+SO42-;
(3)①反应mA+nB?pC,若A、B、C都是气体,减压后正反应速率小于逆反应速率,证明逆向反应是气体体积增大的反应,得到m+n>p,
故答案为:m+n>p;
②若反应mA+nB?pC;C为气体,且m+n=p,在加压时化学平衡发生移动,说明AB中至少有一种是固体或纯液体,加压平衡逆向进行,
故答案为:逆反应;
③若再升高温度,平衡向逆向移动,说明逆反应吸热,则正反应放热,故答案为:放热;
(4)①由反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)可知,Zn元素化合价升高,被氧化,Cu元素化合价降低,被还原,形成原电池知识时,Zn为负极,由图中电子移动方向可知,①为Zn,②为Cu,③为硫酸锌溶液,④为硫酸铜溶液,故答案为: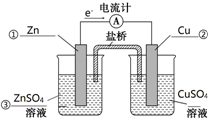 ;
;
②原电池中阴离子移向负极,所以盐桥中的Cl-向Zn电极移动,故答案为:左.
点评 本题考查焓变的计算、电极反应式书写、化学平衡及其移动以及原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.


科目:高中化学 来源: 题型:选择题

| A. | 该晶体的化学式为CaTiO3 | |
| B. | 晶体中每个Ti4+和12个Ca2+相紧邻 | |
| C. | 该晶胞中含有8个Ti4+,6个O2-和一个Ca2+ | |
| D. | 该晶体的溶沸点较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100mL3 mol/L的硝酸中加入5.6g铁 | |
| B. | 用40mL10 mol/L的盐酸与10g二氧化锰共热制取氯气 | |
| C. | 标准状况下,将1g铝片投入20mL18.4mol/L的硫酸中 | |
| D. | 在50MPa、500℃和铁触媒催化的条件下,用1.2mol氮气和3mol氢气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .以下对苯甲酸钠描述错误的是C.
.以下对苯甲酸钠描述错误的是C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法,有机物 可命名为2,6-二甲基-5-乙基辛烷 可命名为2,6-二甲基-5-乙基辛烷 | |
| B. | 若某高聚物对应的单体只有一种,则此高聚物与单体有相同的最简式 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸( )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com