
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为![]() ,他们设计如下实验用于制取氯气并验证其性质。
,他们设计如下实验用于制取氯气并验证其性质。
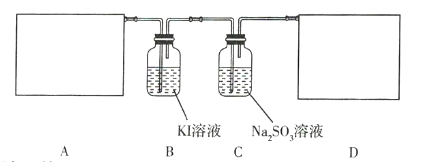
请回答下列问题。
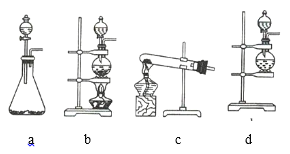
(1)该实验中A部分的装置是 _________________________________ (填序号)。
(2)B中的实验现象为 _____________________________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因: _____________________________。请你帮助他们设计一个实验,证明C中的亚硫酸钠已被氧化: _____________________________(简述实验步骤)。
(4)请根据题意画出D处的实验装置图,并注明装置中盛放的物质__________。
【答案】b 溶液由无色变为黄色(或棕褐色) ![]() 取少量C中的溶液,加入足量的稀盐酸,然后滴加
取少量C中的溶液,加入足量的稀盐酸,然后滴加![]() 溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化
溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化  (答案合理即可)
(答案合理即可)
【解析】
根据题目信息可知漂白粉和硫酸溶液需要加热生成氯气,生成的氯气通入KI溶液,将碘离子氧化为碘单质,通入亚硫酸钠溶液中,氧化亚硫酸根,氯气有毒,过量的氯气需要进行处理。
(1)该反应的反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置b;
(2)氯气有强氧化性,通入KI溶液发生反应:2KI+Cl2=2KCl+I2,所以溶液会从由无色变为黄色(或棕褐色);
(3)氯气有强氧化性,可将亚硫酸根氧化成硫酸根,离子方程式为![]() ;亚硫酸钠被氧化生成硫酸钠,只要验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,具体方法为:取少量C中的溶液,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化;
;亚硫酸钠被氧化生成硫酸钠,只要验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,具体方法为:取少量C中的溶液,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化;
(4)氯气有毒,需要进行尾气处理,所以需要装置: 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】下列反应在任意温度下一定能自发进行的是 ( )
A.2NaCl + 2H2O = 2NaOH + Cl2↑ +H2↑ △H > 0
B.NH3(g) + HCl(g) = NH4Cl(s) △H < 0
C.CaCO3(s) = CaO(s) + CO2(g) △H > 0
D.X2Y2(g) = X2(g) +Y2(g) △H < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100多年前,“化学守护神”德国化学家李比希发现了一种至今仍在临床使用的催眠药(化合物IV)。由源自石油的基本化工原料I合成化合物IV的一种途径为:
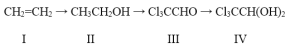
(1)由化合物I合成化合物II的反应类型为______;
(2)下列关于化合物I和化合物II的说法正确的有________(填字母)。
A. 化合物I可以作为植物生长调节剂
B. 化合物I能发生加聚反应,不能使酸性KMnO4溶液褪色
C. 化合物II能发生酯化反应
D. 化合物II不能与金属Na反应
(3)由化合物III合成化合物IV的反应的原子利用率为100%,则除化合物III外,另一种反应物是__。
(4)化合物II与IV都含有的官能团是______(填名称),化合物IV的分子式为____。
(5)为替代日益枯竭的化石资源,有人提出以富含纤维素的农林废弃物或副产物为原料获得乙醇,再制备化合物IV的方案,可用于这种用途的废弃物或副产物有____ (写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 开启啤酒瓶盖,瓶中立即泛起大量泡沫
B. 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
C. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
D. 在pH等于3的醋酸溶液中加入少量CH3COONa,溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的甲、乙、丙、丁代表化学中常见的四种物质,其中甲、乙、丙均含有同一种元素。相互转化的关系如下,请回答下列问题。
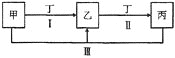
(1)甲气体的水溶液能使酚酞变红,乙为空气中含量最大的气体,写出反应![]() Ⅲ
Ⅲ![]() 的化学方程式:________________________________。
的化学方程式:________________________________。
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应
的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为___________________________________。
的离子方程式为___________________________________。
(3)若乙为淡黄色非金属单质,则反应![]() Ⅲ
Ⅲ![]() 中氧化产物与还原产物的物质的量之比为______________,
中氧化产物与还原产物的物质的量之比为______________,![]() 甲与含
甲与含![]() 的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
(4)若甲、乙、丙的溶液均显碱性,丁为温室效应主要气体。浓度相同的乙、丙溶液pH较大的是______________![]() 填溶质的化学式
填溶质的化学式![]() 溶液,原因是______________________________。
溶液,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应![]() 常用于制作印刷线路板。
常用于制作印刷线路板。
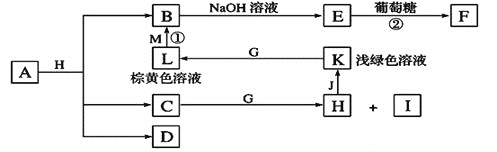
请回答下列问题:
(1)![]() 元素在周期表中的位置______________________,C的电子式______________。
元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________![]() 填写元素符号
填写元素符号![]() 。
。
(3)写出实验室制备G的离子反应方程式:_________________________________。
(4)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为![]() ,其俗名为____________。
,其俗名为____________。
(5)实验室中检验L溶液中的阳离子常选用__________![]() 填化学式
填化学式![]() 溶液,现象是__________________________________________。
溶液,现象是__________________________________________。
(6)![]() 中包含X、Y、Z元素,A的化学式为_________________________________。
中包含X、Y、Z元素,A的化学式为_________________________________。
(7)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: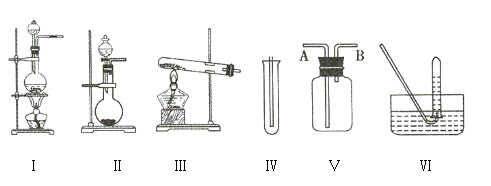
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
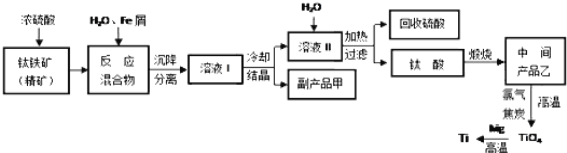
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
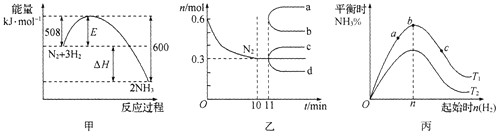
下列说法正确的是 ( )
A.升高温度,该反应的平衡常数增大
B.由图乙信息,从11 min起其他条件不变,压缩容器的体积,则n(N2)的变化曲线为d
C.由图乙信息,10 min内该反应的平均速度v(H2) = 0. 09 mol·L-l·min-l
D.图丙中温度T1 < T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com