
| A、c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3- |
| B、c(OH-)=0.1mol/L的溶液中:CO32-、Cl-、F-、K+ |
| C、含大量Al3+的溶液中:K+、Na+、SO32-、ClO- |
| D、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
| ||
| A、NaAlH4中氢元素为+1价 |
| B、每生成11.2 L(标准状况下)H2,转移2NA个电子 |
| C、在反应中有50%的氢被氧化 |
| D、反应中氧化产物与还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
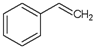 )的叙述,错误的是( )
)的叙述,错误的是( )| A、可以与溴水反应 |
| B、能够使酸性高锰酸钾溶液褪色 |
| C、分子式C8H8 |
| D、1mol苯乙烯可以和1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应在有较多固体析出时停止加热 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂在空气中完全燃烧生成二氧化碳和水 |
| B、蛋白质溶液中加入浓的硫酸铵溶液会发生盐析 |
| C、乙酸乙酯中混有的乙酸杂质可以用饱和碳酸钠溶液除去 |
| D、由CH2=CH-COOCH3合成的聚合物为[CH2-CH-COOCH3]n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.02×1023是阿伏加德罗常数的近似值 |
| B、阿伏加德常数个微粒的物质的量是1mol |
| C、硫酸的摩尔质量是98克 |
| D、1mol 12C原子的质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com