
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| △c |
| △t |
| 1 |
| 3 |
| ||||
| 2min |
| a |
| 12 |
| a |
| 2 |
| ||||
| 2min |
| a |
| 8 |
| a |
| 12 |
| a |
| 8 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(X)mol | 7 | 3 | 1 | 1 |
| n(Y)mol | 5 | 3 | 2 | 2 |
| n(z)mol | 1 | 3 | 4 | 4 |
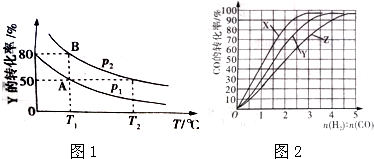
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5s的平均速率v(A)=0.03mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.40mol A、0.40mol B和0.10mol C,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4可以由CH4制得,它可用于萃取碘水中的碘 |
| B、等物质的量的乙醇和乙烯完全燃烧时所需要的氧气质量相等 |
| C、用乙烯与HCl反应来制备1-氯乙烷比用乙烷与氯气反应更好 |
| D、苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、露天焚烧垃圾 |
| B、用煤火力发电 |
| C、开发利用太阳能 |
| D、乱砍滥伐树木 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com