
 .
.
分析 (1)通过X射线衍射区分晶态SiO2和无定形SiO2;
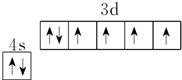
(2)Fe原子价电子排布式为3d64s2,结合泡利原理、洪特规则画出价电子排布图;
(3)非金属性越强,电负性越大;金属性越强,最高价氧化物对应水化物的碱性越强;
(4)SiCl4的熔沸点比较低,属于分子晶体,分子中Si原子形成4个Si-Cl键,Si原子没有孤对电子,杂化轨道数目为4,为正四面体结构,分子中原子均满足8电子结构;
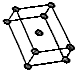
(5)①Ti是六方最密堆积;
②结合晶胞中原子数目,表示出晶胞的质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)通过X射线衍射区分晶态SiO2和无定形SiO2,故答案为:X射线衍射;
(2)Fe原子价电子排布式为3d64s2,结合泡利原理、洪特规则画出价电子排布图为 ,
,
故答案为: ;
;
(3)非金属性越强,电负性越大,非金属性O>Si,则电负性O>Si;金属性越强,最高价氧化物对应水化物的碱性越强,金属性Al>Fe,则碱性Fe(OH)3<Al(OH)3,
故答案为:O>Si;<;
(4)A.SiCl4的熔沸点比较低,属于分子晶体,故A正确;
B.分子中Si原子形成4个Si-Cl键,Si原子没有孤对电子,杂化轨道数目为4,Si原子采用sp3杂化,故B正确;
C.根据价层电子对互斥理论知,为正四面体结构,故C错误;
D.该分子中原子均满足8电子结构,故D正确,
故选:ABD;
(5)①Ti是六方最密堆积,空间利用率是74%,配位数为12,
故答案为:74%;12;
②晶胞质量为2×$\frac{48}{{N}_{A}}$g,若其晶胞体积为V,则晶胞密度=2×$\frac{48}{{N}_{A}}$÷V=$\frac{96}{V{N}_{A}}$,
故答案为:$\frac{96}{V{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、分子结构、晶体类型与性质、晶胞计算等,(5)中空间利用率计算关键是理解原子半径与晶胞棱长关系.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 金刚石 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水滴石穿”是溶解了CO2的雨水与CaCO3的长期作用,生成了可溶性的Ca(HCO3)2 | |
| B. | 新型水处理剂高铁酸钠(Na2FeO4),因为具有强氧化性,所以能对水进行消毒,同时,还原产物能形成带电的氢氧化铁胶体,能使水中的杂质沉降而达到净水的目的 | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可以缓解白色污染 | |
| D. | 如果人觉察到室内煤气浓度较高的时候,应该将头尽量贴地,匍匐行进至门口或者窗口,不要急着打开电灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
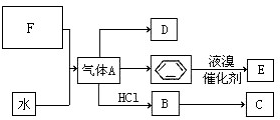 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应; ,其反应类型为加聚反应.
,其反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com