
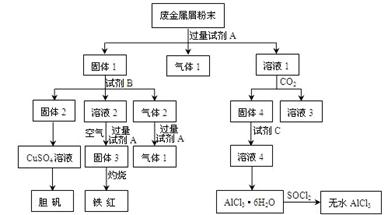


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
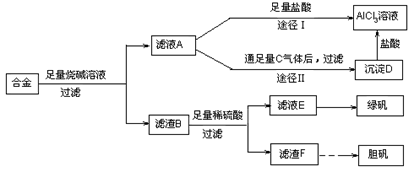
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁路勘探时常用太阳能电池提供能量,太阳能电池是原电池 |
| B.铁轨焊接时常用到铝热反应,铝热反应中放出大量的热足以使铁熔化 |
| C.铁元素在周期表中位于第四周期ⅡB族 |
| D.工业上铁、铝的冶炼均采用热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合金的熔点一般比它的成分金属高 |
| B.合金的硬度一般比它的成分金属低 |
| C.组成合金的元素种类相同,合金的性能就一定相同 |
| D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者对应的氧化物中,氧化铝为两性氧化物,其它的均为碱性氧化物 |
| B.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu 、Fe、Al |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将其溶液直接蒸干的方法 |
| D.配制AlCl3、FeCl3、CuCl2溶液时均需加盐酸抑制水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.6g | B.3.2g | C.6.4g | D.9.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠的金属活泼性大于铜,在溶液中钠可以置换出铜 |
| B.使用托盘天平称量固体药品时左码右物,可能会导致所配溶液浓度偏低 |
| C.碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D.工业上电解熔融MgCl2制取镁,也可电解熔融AlCl3制取铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com