
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
【答案】D
【解析】试题分析:A、曲线x随反应进行浓度逐渐增大,表示生成物的浓度变化。曲线Y随反应进行浓度减小,表示反应物的浓度变化。反应进行到3min时X增加了0.5mol/L,而Y减少了1.0mol/L-0.5mol/L=0.5mol/L,这说明X、Y的浓度变化量之比为1:1,因此根据反应的化学方程式可知曲线x可以表示CH3OH浓度变化,曲线Y可以表示CO2浓度变化,A正确;B、根据以上分析可知X可以表示甲醇,则10min内用甲醇表示的反应速率为=0.75molL÷10min=0.075mol/(Lmin)。反应速率之比等于化学计量数之比,用氢气表示的反应速率=3×0.075mol/(Lmin)=0.225mol/(Lmin),B正确;C、根据以上分析可知X可以表示甲醇,平衡时甲醇的浓度变化量=0.75mol/L,则根据方程式可知氢气的浓度变化量=3×0.75mol/L=2.25mol/L,则参加反应的氢气的物质的量=1L×2.25mol/L=2.25mol,所以氢气的转化率=![]() ×100%=75%,C正确;D、根据以上分析可知X可以表示甲醇,其浓度变化量=0.75mol/L,则:
×100%=75%,C正确;D、根据以上分析可知X可以表示甲醇,其浓度变化量=0.75mol/L,则:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.75 2.25 0.75 0.75
平衡浓度(mol/L) 0.25 0.75 0.75 0.75
因此根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该反应的平衡常数=![]() =5.3,D错误,答案选D。
=5.3,D错误,答案选D。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(Lmin).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(Lmin);
(3)x的值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 molL﹣1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.图①表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的p随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0molL﹣1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液 , 立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,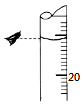
则读数为 mL.若仰视,会使读数偏(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是 molL﹣1 .
滴定 | 待测溶液 | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:

已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com