
【题目】下列反应中,不属于取代反应的是( )
A.甲烷和氯气在光照下发生反应
B.苯和液溴在溴化铁的催化下发生反应
C.乙酸和乙醇在浓硫酸催化下发生反应
D.乙醇和金属钠发生反应
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①溶液都是纯净物 ②含氧的化合物都是氧化物 ③能电离出H+的化合物都是酸 ④能电离出OH-的化合物都是碱 ⑤能电离出金属离子和酸根离子的化合物都是盐 ⑥酸和碱的中和反应都是复分解反应
A.全部
B.⑤⑥
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2S2O8具有强氧化性(S2O82-中含有过氧根),在石油行业中有重要用途,工业上可利用电解法制备它,工作原理如图(电极材料是石墨)所示,下列说法中错误的是
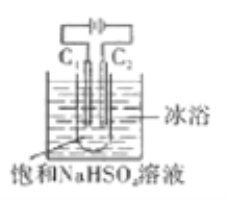
A. C1电极上的电极反应式为:2SO42--2e-=S2O82-
B. 通电后Na+移向C2电极
C. 反应一段时间后,溶液的pH减小
D. 电解过程中,两电极上参与反应的离子的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知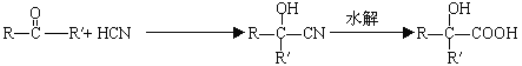 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)写出下列有机物的结构简式:
A___________________C _______________________E ____________________F_________________。
(2)写出下列有关反应的化学方程式:
C →D_______________________;
D →E_______________________;
E→F_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2,回答下列问题:
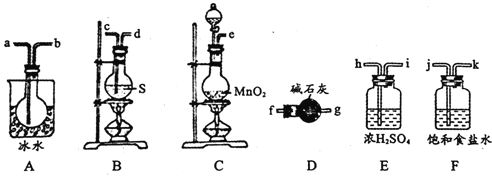
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为________。
(2)制取Cl2应选用的裝置是_______(填字母编号);反应的离子方程式为________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为____(按气流方向,用小写字母表示)。
(4)仪器D的名称是_______;D中碱石灰的作用是________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是____________
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式_________;该反应中被氧化和被还原的元素的质量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成是一个需要经历多步反应的过程,我们常用的塑料包装绳(主要成分为聚氯乙烯 ![]() 就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
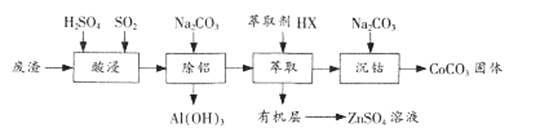
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com