
甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
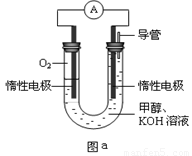
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。

(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
(1)2ΔH1-2ΔH2+ΔH3 (2分) (2) > (2分) <(2分)
(3) 减小 (2分) CH3OH-6e-+8OH-=CO32-+6H2O (3分)
(4)粗铜, 精铜, Ag、Au (3分)
【解析】
试题分析:(1)根据盖斯定律可知,①×2+③-②×2即达到反应2CO(g)+O2(g)=2CO2(g) ,所以该反应的反应热ΔH=2ΔH1-2ΔH2+ΔH3。
(2)根据图像可知在压强相同的条件下,升高温度甲烷的转化率增大,这说明温度升高平衡向正反应方向移动,所以正方应是吸热反应,即△H大于0;正方应是体积增大的可逆反应,则增大压强平衡向逆反应方向移动,甲烷的转化率降低。所以根据图像可知,在温度相同的条件下,P1对应的转化率高,则P1小于P2。
(3)甲醇在反应中失去电子,所以甲醇在负极通入,电极反应式是CH3OH-6e-+8OH-=CO32-+6H2O,即反应后有碳酸钾生成,消耗氢氧化钾,所以溶液的pH减小。
(4)粗铜精练时,粗铜和电源的正极相连,做阳极,纯铜和电源的负极相连,做阴极。粗铜中的Ag、Au等杂质不失去电子,成为阳极泥。
考点:考查反应热的计算、外界条件对平衡状态的影响、电极反应式的判断和书写阳极粗铜的冶炼
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试化学试卷(解析版) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:

①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省潮州市高三上学期期末质检理综化学试卷(解析版) 题型:计算题
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g) 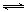 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
CO2(g) + 3H2(g)
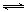 CH3OH(g)
+ H2O(g) ΔH2
CH3OH(g)
+ H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)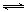 CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
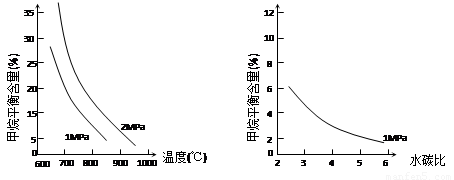
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com