
| n/mol T/�� | ����̿ | NO | E | F |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
���� ��1����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4���ݴ˽��ԭ���غ���ƽ�������ʵ�ϵ����
��2���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ0.03��0.06��0.03��0.03=1��2��1��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ���ʷ�Ӧ����ʽΪ��C+2NO?N2+CO2��
�ټ���������ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��{N}_{2}����c��C{O}_{2}��}{{c}^{2}��NO��}$���㣻
���ɱ������ݿ�֪���¶���T1��ΪT2��ƽ�����淴Ӧ�ƶ�����������Ӧ�����ȣ����Ƿ��Ȳ�ȷ���������ж��¶ȱ仯��
��3������֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ����2-��ɵã�2CO��g��+O2��g���T2CO2��g����
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��
��� �⣺��1����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4�����ԭ���غ���ƽ��ʽΪ��5C+4KMnO4+6H2SO4=5CO2��+4MnSO4+2K2SO4+6H2O��
�ʴ�Ϊ��5��4��6��5��4��2��6��
��2���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ0.03��0.06��0.03��0.03=1��2��1��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ���ʷ�Ӧ����ʽΪ��C+2NO?N2+CO2��
��ƽ��ʱc��NO��=$\frac{0.04mol}{2L}$=0.02mol/L��c��N2��=c��CO2��=$\frac{0.03mol}{2L}$=0.015mol/L����T1��ʱ�÷�Ӧ��ƽ�ⳣ��ΪK1=$\frac{c��{N}_{2}����c��C{O}_{2}��}{{c}^{2}��NO��}$=$\frac{0.015��0.015}{0.0{2}^{2}}$=$\frac{9}{16}$��
�ʴ�Ϊ��$\frac{9}{16}$��
���ɱ������ݿ�֪���¶���T1��ΪT2��ƽ�����淴Ӧ�ƶ�����������Ӧ�����ȣ����Ƿ��Ȳ�ȷ�������ж��¶ȱ仯��
�ʴ�Ϊ��C��
��3������֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ����2-��ɵã�2CO��g��+O2��g���T2CO2��g����H=-566 kJ/mol
�ʴ�Ϊ��2CO��g��+O2��g���T2CO2��g����H=-566 kJ/mol��
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����A��ȷ��
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����B����
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����C����
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����D����
�ʴ�Ϊ��A��
���� ���⿼���Ϊ�ۺϣ��漰������ԭ��Ӧ��ƽ��ƽ�ⳣ���ļ��������á���Чƽ�⡢�Ȼ�ѧ����ʽ��д��Ϊ�߿��������ͣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע����մ����˼·��


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���С�H��0�ķ�Ӧ�����Է���Ӧ | |
| B�� | ������ؼ��ȷֽ���һ���ؼ�С�Ĺ��� | |
| C�� | �����������Զ��ۻ���ˮ���������Ĺ��� | |
| D�� | �Է����еķ�Ӧһ����Ѹ�ٽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
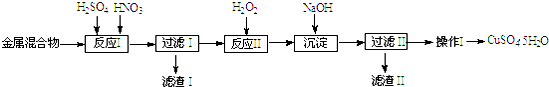
| ������ | Fe3+ | Fe2+ | Cu2+ |
| ��ʼ���� | 1.5 | 6.4 | 4.2 |
| ��ȫ���� | 3.2 | 8.9 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
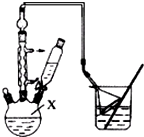 ���嶡�����ӣ�
���嶡�����ӣ�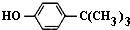 ����ҵ��;�㷺�����������������Է�ȩ��֬���ȶ��������ϵȣ�ʵ�����Ա��ӡ��嶡����[��CH3��3CCl]��Ϊԭ���Ʊ����嶡�����ӣ�ʵ�鲽�����£�
����ҵ��;�㷺�����������������Է�ȩ��֬���ȶ��������ϵȣ�ʵ�����Ա��ӡ��嶡����[��CH3��3CCl]��Ϊԭ���Ʊ����嶡�����ӣ�ʵ�鲽�����£� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ʼ���ʵ���Ũ�ȣ�mol/L�� | 1.5 | 1 | 0 |
| 2sĩ���ʵ���Ũ�ȣ�mol/L�� | 0.9 | 0.8 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | ��Է� ������ | ��״ | �ܶȣ�g/mL�� | �е㣨�棩 | �ܽ��� | |
| ���� | 93 | ��ɫ��״Һ�� | 1.02 | 184.4 | ����ˮ | �������Ҵ������� |
| ���� | 60 | ��ɫҺ�� | 1.05 | 118.1 | ������ˮ | �������Ҵ������� |
| ���� ���� | 135 | ��ɫ���� | 1.22 | 304 | ������ˮ����������ˮ | �������Ҵ������� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���·����� | B�� | ���Ϸ����� | C�� | �ҡ��Ϸ����� | D�� | �ҡ��·����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
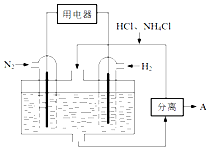 �����仯�����ڹ�ũҵ����������Ӧ�ù㷺�������������⣮
�����仯�����ڹ�ũҵ����������Ӧ�ù㷺�������������⣮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com