
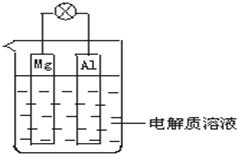
 ČēĶ¼ĖłŹ¾£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā £ØµĘÅŻ¹¦ĀŹŗĻŹŹ£©£ŗ
ČēĶ¼ĖłŹ¾£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā £ØµĘÅŻ¹¦ĀŹŗĻŹŹ£©£ŗ·ÖĪö £Ø1£©øĆ×°ÖĆŹĒ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ£»
£Ø2£©µē½āÖŹČÜŅŗĪŖĻ”H2SO4Ź±£¬Ć¾ŗĶĀĮĮ¬½ÓŌŚĻ”ĮņĖįČÜŅŗÖŠŠĪ³ÉŌµē³Ų£¬Ć¾×öøŗ¼«Ź§µē×ÓÉś³ÉĆ¾Ąė×Ó£¬ĀĮ×öÕż¼«£¬ČÜŅŗÖŠĒāĄė×ÓŌŚĀĮµē¼«ÉĻµĆµ½µē×ÓÉś³ÉĒāĘų£»
£Ø3£©µē½āÖŹČÜŅŗĪŖNaOHČÜŅŗŹ±£¬Ć¾ŗĶĀĮĮ¬½ÓŌŚĒāŃõ»ÆÄĘČÜŅŗÖŠŠĪ³ÉŌµē³Ų£¬ĀĮ×öøŗ¼«Ź§µē×ÓŌŚĒāŃõ»ÆÄĘČÜŅŗÖŠÉś³ÉĘ«ĀĮĖįÄĘČÜŅŗ£¬Ć¾×öÕż¼«£¬ČÜŅŗÖŠĖ®µĆµ½µē×ÓÉś³ÉĒāĘų£®
½ā“š ½ā£ŗ£Ø1£©øĆ×°ÖĆŹĒ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ£¬ĖłŅŌøĆ×°ÖĆŹĒŌµē³Ų£¬¹Ź“š°øĪŖ£ŗŌµē³Ų£»
£Ø2£©µē½āÖŹČÜŅŗĪŖĻ”H2SO4Ź±£¬Ć¾ŗĶĀĮĮ¬½ÓŌŚĻ”ĮņĖįČÜŅŗÖŠŠĪ³ÉŌµē³Ų£¬µēĀ·ÖŠÓŠµēĮ÷Éś³É£¬µĘÅŻĮĮ£¬Ć¾×öøŗ¼«Ź§µē×ÓÉś³ÉĆ¾Ąė×Ó£¬µē¼«·“Ó¦ĪŖ£ŗMg-2e-=Mg2+£»ĀĮ×öÕż¼«£¬ČÜŅŗÖŠĒāĄė×ÓŌŚĀĮµē¼«ÉĻµĆµ½µē×ÓÉś³ÉĒāĘų£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2H++2e-=H2”ü£¬
¹Ź“š°øĪŖ£ŗøŗ£»Õż£»Ć¾£»×ó£»Mg-2e-=Mg2+£»2H++2e-=H2”ü£»
£Ø3£©µē½āÖŹČÜŅŗĪŖNaOHČÜŅŗŹ±£¬Ć¾ŗĶĀĮĮ¬½ÓŌŚĒāŃõ»ÆÄĘČÜŅŗÖŠŠĪ³ÉŌµē³Ų£¬µēĀ·ÖŠŠĪ³ÉµēĮ÷£¬µĘÅŻĮĮ£»ĀĮ×öøŗ¼«Ź§µē×ÓŌŚĒāŃõ»ÆÄĘČÜŅŗÖŠÉś³ÉĘ«ĀĮĖįÄĘČÜŅŗ£¬µē¼«·“Ó¦ĪŖ£ŗAl-3e-+4OH-=AlO2-+H2O£¬Ć¾×öÕż¼«£¬ČÜŅŗÖŠĖ®µĆµ½µē×ÓÉś³ÉĒāĘų£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2H2O+2e-=H2”ü+2OH-£¬
¹Ź“š°øĪŖ£ŗÕż£»øŗ£»ĀĮ£»ŅõĄė×Ó£»2H2O+2e-=H2”ü+2OH-£»Al-3e-+4OH-=AlO2-+H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖŌµē³ŲŌĄķµÄ·ÖĪöÅŠ¶Ļ£¬µē¼«·“Ó¦”¢µē¼«²śĪļÅŠ¶ĻŹĒ½āĢā¹Ų¼ü£¬Ōµē³Ų·“Ó¦ÖŠŠĪ³ÉµēĮ÷£¬ĢāÄæ½Ļ¼ņµ„£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ø£¶ūĀķĮÖ | B£® | ¾ŪŅŅĻ© | C£® | ĻĖĪ¬ĖŲ | D£® | Ó²Ö¬ĖįøŹÓĶõ„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŃÖŖ2H2£Øg£©+O2£Øg£©=2H2O£Øg£©”÷H=-483.6kJ/mol£¬ŌņĒāĘųµÄČ¼ÉÕČČĪŖ241.8kJ/mol | |
| B£® | ŗ¬20.0g NaOHµÄĻ”ČÜŅŗÓėĻ”ĮņĖįĶźČ«ÖŠŗĶ£¬·Å³ö28.7kJµÄČČĮ棬Ōņ±ķŹ¾øĆ·“Ó¦ÖŠŗĶČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗNaOH£Øaq£©+$\frac{1}{2}$H2SO4 £Øaq£©=NaCl£Øaq£©+H2O£Øl£©”÷H=-57.4kJ/mol | |
| C£® | ŅŃÖŖC£ØŹÆÄ«£¬s£©=C£Ø½šøÕŹÆ£¬s£©”÷H£¾0£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | |
| D£® | ŅŃÖŖI2£Øg£©+H2£Øg£©=2HI£Øg£©”÷H1£¼0£»I2£Øs£©+H2£Øg£©=2HI£Øg £©”÷H2£¼0£¬Ōņ”÷H1£¾”÷H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaNO3 | B£® | MgO | C£® | C2H6 | D£® | CO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | OH- | B£® | HF | C£® | NO | D£® | H3O+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
ŹµŃé »ģŗĻČÜŅŗ | A | B | C | D | E | F |
| 4mol/L H2SO4£ØmL£© | 30 | V1 | V2 | V3 | V4 | V5 |
| ±„ŗĶCuSO4ČÜŅŗ£ØmL£© | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O£ØmL£© | V7 | V8 | V9 | V10 | 10 | 0 |
| ŹµŃéŠņŗÅ | ½šŹōÖŹĮæ/g | ½šŹōדĢ¬ | C£ØH2SO4£©/mol£®-L | V£ØH2SO4£©/mL | ČÜŅŗĪĀ¶Č | ½šŹōĻūŹ§µÄŹ±¼ä/s | |
| ·“Ó¦Ē° | ·“Ó¦ŗó | ||||||
| 1 | 0.1 | Ėæ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | ·ŪÄ© | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | Ėæ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | Ėæ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | ·ŪÄ© | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | Ėæ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | Ėæ | 1.0 | 50 | 35 | 50 | 50 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 35ClŌ×ÓĖłŗ¬ÖŹ×ÓŹżĪŖ18 | |
| B£® | $\frac{1}{18}$molµÄ1H35Cl·Ö×ÓĖłŗ¬ÖŠ×ÓŹżŌ¼ĪŖ6.02”Į1023 | |
| C£® | 3.5g35Cl2ĘųĢåµÄĢå»żŌ¼ĪŖ1.12L | |
| D£® | 35Cl2ĘųĢåµÄĦ¶ūÖŹĮæĪŖ70 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com