
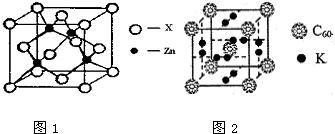
 [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质]| 1 |
| 2 |
| 5+3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性:X比Y强 |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的最高价氧化物对应的水化物能溶于的Z最高价氧化物对应的水化物的稀溶液中 |
| D、一定条件下,W单质可以和Z氢化物反应直接生成ZW2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
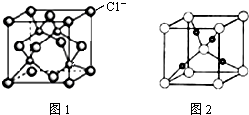 我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.
我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
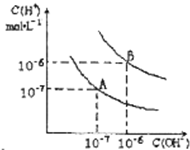 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
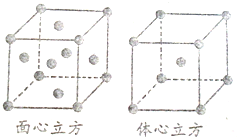 (1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 | B、增大压强 |
| C、加入催化剂 | D、减少C的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com