
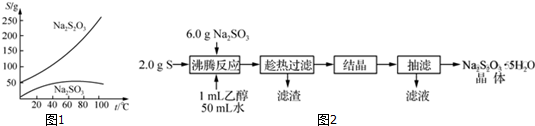
分析 (1)在生成Na2S2O3的反应中,只有硫难溶于水,所以过滤应该是除去过量的硫,趁热过滤防止温度降低而使Na2S2O3•5H2O析出;
(2)由溶解度曲线可知,Na2S2O3溶解度受温度影响较大,应采取冷却(或降温)结晶;
(3)由题目信息,可知Na2S2O3无色易溶于水的晶体,不溶于乙醇,应选择乙醇进行洗涤;
(4)根据消耗I2计算每份样品中n(Na2S2O3),进而计算Na2S2O3反应生成二氧化硫,判断每份样品中是否含有亚硫酸钠,若有,根据二氧化硫计算亚硫酸钠的物质的量,再根据每份样品中Na2S2O3•5H2O、亚硫酸钠的总质量判断是否含有硫酸钠.
解答 解:(1)在生成Na2S2O3的反应中,只有硫难溶于水,所以过滤应该是除去过量的硫,得到的滤渣为硫,化学式为S,趁热过滤,防止温度降低而使Na2S2O3•5H2O析出,
故答案为:防止温度降低而使Na2S2O3•5H2O析出;S;
(2)由溶解度曲线可知,Na2S2O3溶解度受温度影响较大,直接蒸发结晶易使Na2S2O3•5H2O熔化、分解,应采取冷却(或降温)结晶,
故答案为:冷却(或降温)结晶;
(3)由题目信息,可知Na2S2O3无色易溶于水的晶体,不溶于乙醇,应选择无水乙醇进行洗涤,故选:A;
(4)①n(Na2S2O3•5H2O)=2n(I2)=2×0.0250 L×0.0500mol/L=0.0025mol,
m(Na2S2O3•5H2O)=0.0025mol×248g/mol=0.62g,
所以1.5080g 样品中含有Na2S2O3•5H2O质量是0.62g×2=1.24g,
故答案为:1.24g;
②n(SO2)=0.0672L÷22.4L/mol=0.003 mol,
Na2S2O3•5H2O反应生成二氧化硫为0.003mol,故应含有Na2SO3,其物质的量为0.003mol-0.0025mol=0.0005mol,
每份样品中Na2S2O3•5H2O、Na2SO3的总质量为0.62g+0.0005mol×126g/mol=0.683g<0.7540g,故应含有Na2SO4,则每份样品中Na2SO4的质量为0.7540g-0.683g=0.071g,n(Na2SO4)=0.0005mol,样品成分是:Na2S2O3•5H2O、Na2SO3、Na2SO4,n(Na2S2O3•5H2O):n(Na2SO3):n(Na2SO4)
=0.0025mol:0.0005mol:0.0005mol=5:1:1,
答:样品成分为Na2S2O3•5H2O、Na2SO3、Na2SO4,三者物质的量之比为5:1:1.
点评 本题是对实验制备方案综合考查,涉及物质的分离提纯、物质组成含量的测定,充分考查学生的分析、理解能力及化学实验能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是氧化剂 | B. | NH3被氧化 | ||
| C. | NO只是还原剂 | D. | 生成60gNO转移的5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com