
下列目的能达到的是( )
A.将58.5 g NaCl溶于1 L水中可得1 mol/L的NaCl溶液
B.将标准状况下22.4 L HCl溶于1 L水中可得1 mol/L盐酸
C .将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
.将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
D.将78 g Na2O2溶于水,配成1 L溶液可得到浓度为2 mol/L溶液
科目:高中化学 来源: 题型:
人们对苯及芳香烃的认识有一个不断深化的过程。回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式:________。
(2)已知分子式为C6H6的有机物有多种,其中的两种为:(Ⅰ)  和(Ⅱ)
和(Ⅱ) 。
。
①这两种结构的区别表现在以下两方面:
定性方面(即化学性质方面):Ⅱ能________(填字母),而Ⅰ不能。
a.被高锰酸钾酸性溶液氧化
b.与溴水发生加成反应
c.与溴发生取代反应
d.与氢气发生加成反应
定量方面(即消耗反应物的量方面):1 mol C6H6与H2加成时:Ⅰ需________ mol,而Ⅱ需________ mol。

②今发现C6H6还可能有一种如图所示的立体结构,该结构的二氯代物有______种。
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是________(填字母)。

(4)萘的结构简式不能解释的事实是________(填字母)。
a.萘不能使高锰酸钾酸性溶液褪色
b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上
d.一溴代萘(C10H7Br)只有两种同分异构体
(5)现代化学认为,萘分子中碳碳键是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO 的物质的量浓度为( )
的物质的量浓度为( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某地酸雨经检验除含H+外[c(OH-)可 以忽视]还有Na+、Cl-、NH
以忽视]还有Na+、Cl-、NH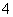 、SO
、SO 其浓度依次为:c(Na+)=2.3×10-5 mol/L,c(Cl-)=3.5×10-5 mol/L,c(NH
其浓度依次为:c(Na+)=2.3×10-5 mol/L,c(Cl-)=3.5×10-5 mol/L,c(NH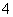 )=2.3×10-5 mol/L,c(SO
)=2.3×10-5 mol/L,c(SO )=1.05×10-5 mol/L,则该地酸雨的pH为( )
)=1.05×10-5 mol/L,则该地酸雨的pH为( )
A.3 B.4
C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有(填序号)__________;
(2)其中确定50 mL溶液体积的容器是(填名称)__________;
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将____________(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度] 抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:
2MnO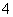 +5H2C2O4+6H+===2Mnx++10CO2↑+8H2O
+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O
则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________ mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲乙两只烧杯中分别盛有 的硫酸和
的硫酸和 溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为
溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为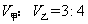 则加入的铝粉的质量为( )
则加入的铝粉的质量为( )
A、
B、
C、
D、
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是( )
A.Cu(OH)2难溶于水,属于非电解质
B.SO2能与碱反应生成盐和水,属于酸性氧化物
C.NH4Cl组成中不含金属离子,不属于盐
D.HCl气体溶于水电离成H+和Cl-,属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com