
分析 (1)反应2H2S+SO2═3S↓+2H2O中硫元素的化合价变化为:由+4价、-2价分别变为0价,该反应中氧化产物和还原产物都是硫单质;
(2)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12;
(3)反应中Fe元素化合价由+2价升高到+3价,Cl元素化合价由0价降低到-1价;
(4)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,氨气作还原剂,氯气作氧化剂,氯化铵为还原产物,被氧化的氨气:参加反应的氨气之比为1:4.
解答 解:(1)反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为 ,故答案为:
,故答案为: ;
;
(2)应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12,用单线桥表示电子转移的情况为: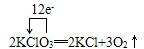 ,氧化产物和还原产物的物质的量之比为3:2,
,氧化产物和还原产物的物质的量之比为3:2,
故答案为: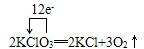 ;3:2;
;3:2;
(3)反应中Fe元素化合价由+2价升高到+3价,Cl元素化合价由0价降低到-1价,用单线桥表示电子转移的情况为: ,
,
故答案为: ;
;
(4)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为 ,被氧化的氨气:参加反应的氨气之比为1:4.故答案为:
,被氧化的氨气:参加反应的氨气之比为1:4.故答案为: ;1:4.
;1:4.
点评 本题考查较为综合,全面考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应中NaH作为还原剂.
,反应中NaH作为还原剂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

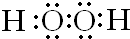 ,C元素在周期表中的位置是第二周期、第ⅦA族.
,C元素在周期表中的位置是第二周期、第ⅦA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com