
A.金属晶体是通过金属原子与自由电子之间存在的较强的作用而形成的
B.金属晶体中自由电子为许多金属离子所共有
C.金属晶体中金属离子以密集的方式堆积,使自由电子不能定向运动
D.金属熔化,金属离子与自由电子之间的作用力减弱
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:重庆市西南大学附属中学2011-2012学年高二下学期期中考试化学试题 题型:022
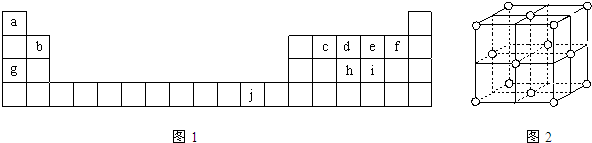
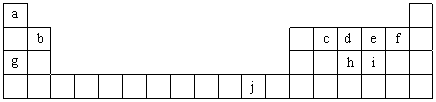
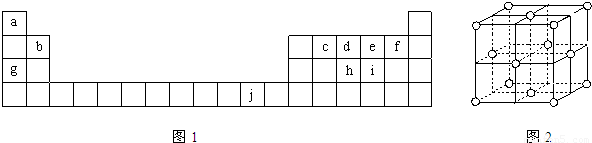
下表为周期表的一部分,表中所列的字母分别代表一种化学元素.
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式________.
(2)在c6a6分子中,元素c为________杂化,该分子是________分子(填“极性”或“非极性”).
(3)ci2分子的电子式为________,ci2与ce2比较,沸点较高的是________(写分子式).
(4)第一电离能:h________i;电负性:g________b(填“>”、“<”或“=”).
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是________.
A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素
B.d的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是________,写出蓝色沉淀溶解在氨水中的离子方程式________.
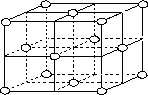
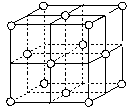
(7)j的金属晶体的晶胞如图所示,则一个晶胞中j原子的个数是________个.
查看答案和解析>>
科目:高中化学 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
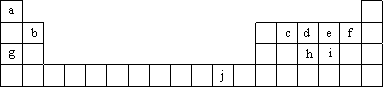
(16分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。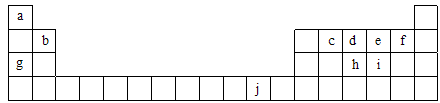
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式___________________________。
(2)在c6a6分子中,元素c为 杂化,该分子是 分子(填“极性”或“非极性”)。
(3)ci2分子的电子式为_________________________,ci2与ce2比较,沸点较高的是_____________(写分子式)。
(4)第一电离能:h______i;电负性:g______b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
| A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素 |
| B.d的基态原子中,2p能级为半充满,属于p区元素 |
| C.最外层电子排布式为4s1,一定属于ⅠA族 |
| D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
用化学用语回答下列问题:
写出元素f的基态原子核外电子排布式___________________________。
在c6a6分子中,元素c为 杂化,该分子是 分子(填“极性”或“非极性”)。
ci2分子的电子式为_________________________,ci2与ce2比较,沸点较高的是_____________(写分子式)。
第一电离能:h______i;电负性:g______b(填“>”、“<”或“=”)。
下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素
B.d的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是____________________,写出蓝色沉淀溶解在氨水中的离子方程式______________________________________________________________________。
j的金属晶体的晶胞如图所示,则一个晶胞中j原子的个数是_______个。
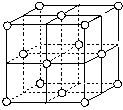
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省泸州市古蔺中学高二(上)期末化学预测试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com