
【题目】将2.4g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44g,碱石灰增重1.76g,氧化铜减轻0.64g。下列说法中不正确的是
A. M的实验式为CH2O
B. 若要得到M的分子式,还需要测得M的相对分子质量或物质的量
C. 若M的相对分子质量为60,则M一定为乙酸
D. 通过红外光谱仪可分析M中的官能团
【答案】C
【解析】
浓硫酸增重1.44g,说明燃烧产物水的物质的量为![]() =0.08mol;碱石灰增重1.76g,说明燃烧产物CO2的物质的量为
=0.08mol;碱石灰增重1.76g,说明燃烧产物CO2的物质的量为![]() =0.04mol;氧化铜减轻0.64g,说明燃烧产物CO的物质的量为
=0.04mol;氧化铜减轻0.64g,说明燃烧产物CO的物质的量为![]() =0.04mol;则此有机物中含有碳原子0.08mol,氢原子0.16mol,氧原子的物质的量为
=0.04mol;则此有机物中含有碳原子0.08mol,氢原子0.16mol,氧原子的物质的量为![]() =0.08mol;A.有机物M中C︰H︰O=0.08mol︰0.16mol︰0.08mol=1:2:1,则 M的实验式为CH2O,故A正确;B.有M的最简式,若要得到M的分子式,则还需要测得M的相对分子质量或物质的量,故B正确;C.若M的相对分子质量为60,则M的分子式为C2H4O2,但不一定为乙酸,还可能是甲酸甲酯或2-羟基乙醛,故C错误;D.利用红外光谱仪可分析有机物中的官能团,故D正确;答案为C。
=0.08mol;A.有机物M中C︰H︰O=0.08mol︰0.16mol︰0.08mol=1:2:1,则 M的实验式为CH2O,故A正确;B.有M的最简式,若要得到M的分子式,则还需要测得M的相对分子质量或物质的量,故B正确;C.若M的相对分子质量为60,则M的分子式为C2H4O2,但不一定为乙酸,还可能是甲酸甲酯或2-羟基乙醛,故C错误;D.利用红外光谱仪可分析有机物中的官能团,故D正确;答案为C。


科目:高中化学 来源: 题型:
【题目】将200mLH2SO4和Fe2(SO4)3的混合溶液分成两等份,向其中一份中加入足量铁粉,充 分反应后测得固体质量减少3.36g;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到23.3g白色沉淀。请计算:
(1)原溶液中c(SO42﹣)=_____。
(2)原溶液中H2SO4和Fe2(SO4)3的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )

A. 只有④ B. 只有③
C. ③和④均错误 D. 全部错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2 L氟化氢所含分子数为0.5NA
B.1 L 1 mol·L-1的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.在0 ℃时,22.4 L氢气中含有2NA个氢原子
D.1 mol乙烷分子中共价键总数为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
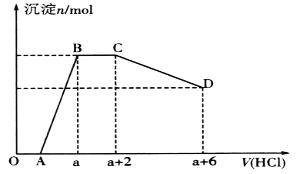
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
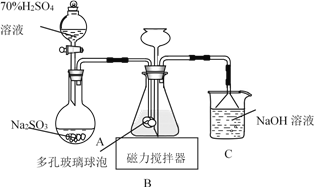
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是 ( )
A.3Fe + 4H2O(g) ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
B.3NO2 +H2O = 2HNO3+ NO
C.Ca(OH)2+SO2 = CaSO3 + H2 O
D.Cu+2H2SO4 (浓)![]() CuSO4+SO2↑+ 2H2O
CuSO4+SO2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H2O2 + 2H2CrO4 = 2Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥或双线桥法标明电子转移的方向和数目。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是
A.常温常压下,15g的—12CH3中含有中子数6NA
B.46 g乙醇和46 g甲酸含有的氧原子数均为NA
C.32g甲醇中含有C—H键的数目为4NA
D.标准状况下,1L甲醛完全燃烧所生成的气态产物的分子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com