
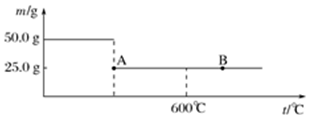
分析 (1)A温度下,固体质量减轻为50g-25g=25g,50gNa2SO3•7H2O中结晶水的质量为50g×$\frac{18×7}{126+18×7}$=25g,则该温度下分解完全失去结晶水;
发现B点溶液的pH大于A点溶液的pH,结合亚硫酸、氢硫酸的电离平衡常数,可以判断B点分解生成物中有硫化钠,属于氧化还原反应,则还有硫酸钠生成;
(2)利用与盐酸反应生成臭鸡蛋气味气体检验硫化钠,利用与硫酸钡溶液检验硫酸钠.
解答 解:(1)A温度下,固体质量减轻为50g-25g=25g,50gNa2SO3•7H2O中结晶水的质量为50g×$\frac{18×7}{126+18×7}$=25g,则该温度下分解完全失去结晶水,反应方程式为:Na2SO3•7H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+7H2O,
发现B点溶液的pH大于A点溶液的pH,结合亚硫酸、氢硫酸的电离平衡常数,可以判断B点分解生成物中有硫化钠,属于氧化还原反应,则还有硫酸钠生成,反应方程式为:4Na2SO3$\frac{\underline{\;>600℃\;}}{\;}$3Na2SO4+Na2S,
故答案为:Na2SO3•7H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+7H2O;4Na2SO3$\frac{\underline{\;>600℃\;}}{\;}$3Na2SO4+Na2S;
(2)检验B温度下产物的成分实验方案为:取B温度下的固体产物少许,加水溶解,向溶液中加入足量的盐酸有臭鸡蛋气味的气体产生,再加氯化钡溶液有白色沉淀生成,则证明产物为Na2SO4、Na2S,
故答案为:取B温度下的固体产物少许,加水溶解,向溶液中加入足量的盐酸有臭鸡蛋气味的气体产生,再加氯化钡溶液有白色沉淀生成,则证明产物为Na2SO4、Na2S.
点评 本题考查物质性质探究实验、物质组成的测定、化学计算等,是对学生综合能力的考查,关键是原理的理解,较好的考查学生分析解决化学问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| B. | 氢能是一种新型能源,具有热值高、资源丰富、无毒、无污染的优点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 合成氨工业中,使用催化剂不能提高H2和N2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁醇的结构简式可写作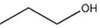 | |
| B. | 氨基酸合成多肽链属于加聚反应 | |
| C. | 分子式为C4H8O2,既含有羟基又含有醛基的同分异构体有5种 | |
| D. | 糖、油脂、蛋白质等这些人体必需的营养物质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com