
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
分析 A.二氧化碳不具有还原性;
B.依据过氧化钠、氧化钠与二氧化碳反应产物解答;
C.镁与热水反应生成氢氧化镁和氢气,钾与水反应生成氢氧化钾和氢气;
D.锂与氧气反应产物只有氧化锂.
解答 解:A.二氧化碳不具有还原性,不能被氯气氧化,故A错误;
B.Na2O2、Na2O组成元素相同,过氧化钠与CO2反应生成碳酸钠和氧气,氧化钠与二氧化碳反应生成碳酸钠,所以二者反应产物不相同,故B错误;
C.镁与热水反应生成氢氧化镁和氢气,钾与水反应生成氢氧化钾和氢气,故C正确;
D.锂与氧气反应产物只有氧化锂,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉二氧化硫、钠的氧化物、镁、钾、锂的性质是解题关键,题目难度不大,掌握基础是解题关键.


科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓H2SO4 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
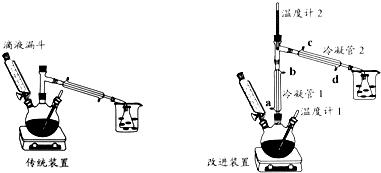
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该氧原子的摩尔质量是aNAg | |
| C. | Wg该氧原子的物质的量是$\frac{W}{{(a•N}_{A})mol}$ | |
| D. | Wg该氧原子所含质子数是$\frac{16W}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
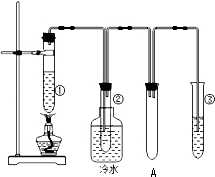 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水. B.
B.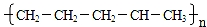
 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com