
【题目】下列装置或操作能达到实验目的的是( )
A.装置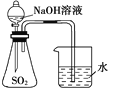 可用于证明
可用于证明![]() 与NaOH溶液发生了反应
与NaOH溶液发生了反应
B.装置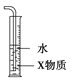 中X为
中X为![]() ,可用于吸收氨或氯化氢
,可用于吸收氨或氯化氢
C.装置 可用于实验室从食盐水中提取氯化钠
可用于实验室从食盐水中提取氯化钠
D.装置 可用于证明浓硫酸与乙醇共热生成乙烯
可用于证明浓硫酸与乙醇共热生成乙烯
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的二元酸
的二元酸![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的
溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的![]() 。下列说法中不正确的是
。下列说法中不正确的是 ![]()
![]()

A.二元酸![]() 的电离方程式为:
的电离方程式为:![]()
![]()
B.当溶液中![]() 和NaHA物质的量相等时:
和NaHA物质的量相等时:![]()
C.在x点溶液中离子浓度大小关系:![]()
D.常温下![]() 的电离常数为
的电离常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)下图是一种工业制取纯碱的生产流程简图:

(1)饱和食盐水中先通![]() 后通
后通![]() 的原因是___________。
的原因是___________。
(2)生成沉淀A的化学方程式为_____;将石灰乳加入滤液B中发生反应的化学方程式为_______。
(3)流程甲中可循环利用的物质的名称为________。
(二)某化工厂对流程甲进行了如图所示的改进。

(4)流程乙中可以循环利用物质的化学式为____;和流程甲相比,流程乙的优点是____。
(5)不用其他试剂,检验流程乙中副产品F是否纯净的操作是_____________。
(6)在流程乙中,若使用11.7 t食盐,最终得到10.07 t纯碱,则NaCl的利用率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) ΔH=-272kJmol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+H2O(g) ΔH=+138kJmol-1
写出工业上以NH3、CO2为原料合成尿素和H2O(g)的热化学方程式:___。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)2CO2(g)+S(s)。若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min内平均反应速率v(CO)=___,该温度下反应的化学平衡常数K=___。
(3)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图1所示。

a.过程2的反应式为___。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是___。
②室温下,(NH4)2SO3溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=___。

(4)用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的Cl2氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为NO3-的离子方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
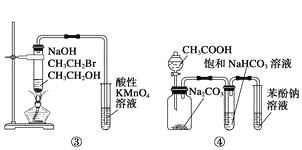
【题目】下列关于各实验装置图的叙述中正确的是
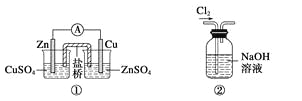
A.装置①:构成锌—铜原电池
B.装置②:除去Cl2中含有的少量HCl
C.装置③:验证溴乙烷发生消去反应生成烯烃
D.装置④:由实验现象推知酸性强弱顺序为:CH3COOH>H2CO3>C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
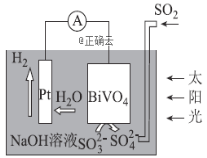
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为![]()
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为____________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com