

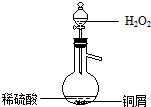
 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.分析 (1)铜与稀硫酸不反应,需要先将铜在空气中加热氧化生成氧化铜,再溶解于稀硫酸,然后将硫酸铜溶液加热蒸发浓缩,冷却结晶、过滤、洗涤并干燥,即可得到硫酸铜晶体;
①铜加热氧化的现象可结合铜和氧化铜的颜色判断;
②从溶液中获得晶体的常见方法是蒸发浓缩、冷却结晶、过滤及洗涤、干燥;
(2)惰性电极电解硫酸铜溶液,阴极发生发生还原反应,溶液里的铜离子被还原为铜;当电解到溶液为无色时,溶液里Cu2+完全还原生成铜,阴、阳极质量差即为生成铜的质量,根据原子守恒可计算出硫酸铜的质量,再计算硫酸铜的溶解度;
(3)双氧水的氧化性比稀硫酸强的多,可以将铜氧化,氧化后的铜和稀硫酸反应.
解答 解:(1)铜与稀硫酸不反应,需要先将铜在空气中加热氧化生成氧化铜,再溶解于稀硫酸,然后将硫酸铜溶液加热蒸发浓缩,冷却结晶、过滤、洗涤并干燥,即可得到硫酸铜晶体;
①铜在空气中加热,看到的现象是红色的铜转化为黑色粉末,故答案为:红色固体转化为黑色粉末;
②获得硫酸铜晶体的方法是将溶液蒸发浓缩、冷却结晶、过滤及洗涤、干燥,故答案为:将溶液蒸发浓缩、冷却结晶、过滤及洗涤、干燥;
(2)用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是Cu2++2e-=Cu;析出铜为4g,其物质的量为4g÷64g/mol=1/16mol,则硫酸铜的质量为160g/mol×1/16mol=10g,则此温度下硫酸铜的溶解度=$\frac{10g}{60g-10g}×100g$=20g,故答案为:20g;
(3)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是:铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解.
点评 本题考查了常见物质的制取原理,实验流程分析及实验方法的设计判断,涉及混合物的分离提纯等基本操作、电解原理与溶解度的计算及氧化还原反应的分析,难度中等,重视基础考查.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,正反应速率与逆反应速率不相等 | |
| B. | 反应过程中,Y的单质的体积分数始终为50% | |
| C. | 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 | |
| D. | 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
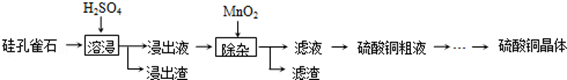
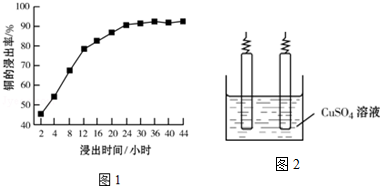
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
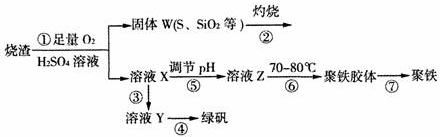
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
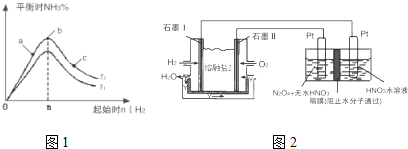
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com