
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
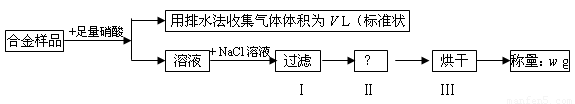
下列说法中不正确的是
A.收集到的V L气体为 NO、NO2
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: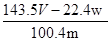 ×100%
×100%
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
| 286(44m1-18m2) |
| 180×44m |
| 286(44m1-18m2) |
| 180×44m |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010—2011年江苏泰州中学上学期高三质量检测化学卷 题型:填空题
(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三上学期9月月考化学试卷 题型:填空题
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com