
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol/LCH3COOH溶液中加入少量水,溶液中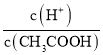 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中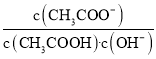 增大
增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+):c(Cl-)>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中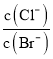 不变
不变
【答案】D
【解析】
A.加水促进弱电解质的电离,因此溶液n(H+)增大,n(CH3COOH)减小;
B.从20℃升温至30℃,促进水解,Kh增大;
C.向盐酸中加入氨水至中性,则c(H+)=c(OH-),结合电荷守恒分析;
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,c(Ag+)相同,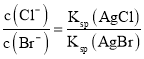 。
。
A.Ka=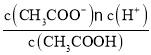 ,加水虽然促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,则溶液中
,加水虽然促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,则溶液中 增大,A错误;
增大,A错误;
B.从20℃升温至30℃,促进水解,Kh增大,则溶液中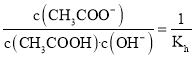 减小,B错误;
减小,B错误;
C.向盐酸中加入氨水至中性,则c(H+)=c(OH-),根据溶液中电荷守恒可知,溶液中c(NH4+)=c(Cl-),所以c(NH4+):c(Cl-)=1,C错误;
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,c(Ag+)相同,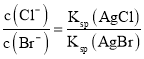 ,Ksp只与温度有关,温度不变,因此溶液中
,Ksp只与温度有关,温度不变,因此溶液中 不变,D正确;
不变,D正确;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列6组物质:①![]() 与
与![]() ;②N4与N2;③H2O2与H2O;④冰与水;⑤
;②N4与N2;③H2O2与H2O;④冰与水;⑤ 与
与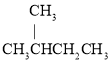 ;⑥C2H2与C2H4。请用序号填写下列空白:
;⑥C2H2与C2H4。请用序号填写下列空白:
互为同位素的是______;互为同素异形体的是______;互为同分异构体的是______;属于同一种化合物的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
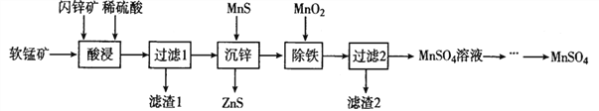
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。下列说法正确的是( )
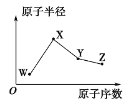
A.对应气态氢化物的稳定性:Y > W
B.对应简单离子的半径:W>Z
C.化合物XZW中既含离子键又含共价键
D.Y的氧化物能与Z的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
![]()
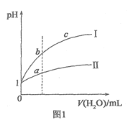

A.图1表示相同温度下![]() 的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中在b点对应温度下,将![]() 的
的![]() 与
与![]() 的NaOH溶液等体积混合后,溶液显中性
的NaOH溶液等体积混合后,溶液显中性
C.图1中,b点酸的总浓度大于a点酸的总浓度
D.图2中纯水仅升高温度,就可以从a点变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
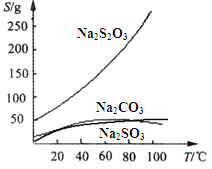
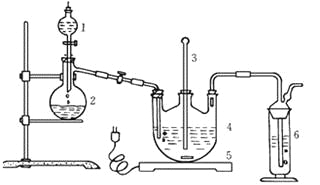
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com