
| A、向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+ | B、向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原溶液中含有Fe2+ | C、向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | D、向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
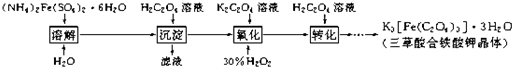
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭州二中高三6月热生考(理综)化学试题 题型:实验题
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体 与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是
该反应的化学方程式
实验室通常用 法收集氨气,检验该气体是否收集满方法
⑵装置③、④若用同一装置,则该装置中所盛装的药品是
| A.Na2O2 | B.浓硫酸 | C.P2O5 | D.碱石灰 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三6月热生考(理综)化学试题 题型:实验题
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4

试回答下列问题:

⑴实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是
该反应的化学方程式
实验室通常用 法收集氨气,检验该气体是否收集满方法
⑵装置③、④若用同一装置,则该装置中所盛装的药品是
A.Na2O2 B.浓硫酸 C.P2O5 D.碱石灰
⑶装置⑥中,粗玻璃管X的作用 ,装置⑦的作用
⑷装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸若参加反应的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则装置⑤中NO的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(22分)Ⅰ.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,同答下列问题:(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入![]() 后,则可使铜溶解。该反应的离子方程式为_______________________________。
后,则可使铜溶解。该反应的离子方程式为_______________________________。
某同学未加入氧化剂,而是将它设计成一个电解装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
|
(2)在一定体积的18 mol?L![]() 的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
的浓硫酸中加入过量的铜片,加热使之反直,被还原的硫酸是0.9mol,则该硫酸的实际体积_______(填“大于”、“等于”或“小于”)100mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?_______________(填“可行”或“不可行”)。
Ⅱ.某化学小组欲探究铁及其忱合物的氧化性和还原性,请回答下列问题:
试剂:铁粉、![]() 溶液、
溶液、![]() ,溶液、氯水、锌片、铜片、
,溶液、氯水、锌片、铜片、![]() 溶液。
溶液。
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是________________。
(2)实验记录(划斜线部分不必填写):
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在 | 溶液由浅绿色变为棕黄色 |
|
|
② | 在 |
|
|
|
③ | 在 |
|
|
|
④ |
|
|
|
|
实验结论:![]() 只有还原性,
只有还原性,![]() 只有氧化性,
只有氧化性,![]() 既有氧化性,又有还原性。
既有氧化性,又有还原性。
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化_____________________________________________________,
并简述![]() 的检验的方法_________________________________________________________
的检验的方法_________________________________________________________
_____________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com