
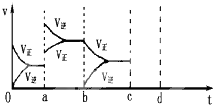
 如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是
如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 3 |
| 73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 14 |
| 6 |
| 14 |
| 7 |
| 16 |
| 8 |
| 35 |
| 17 |
| 235 |
| 92 |
| 238 |
| 92 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 叶绿素 |
| 光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A、分子式为C7H6O5 |
| B、可发生氧化、取代和加成反应 |
| C、分子中含有两种官能团 |
| D、在水溶液中羟基和羧基均能电离出氢离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com