
| A. | 海水提溴过程中,提取溴单质只能用有机物萃取的方法 | |
| B. | 电解饱和食盐水可制得金属钠 | |
| C. | 海水晒盐过程中主要涉及物理变化 | |
| D. | 海带提碘中,氧化过程可通入过量的氯气 |
分析 A、海水中提取溴单质,Br元素化合价由-1价变为0价;
B、电解饱和食盐水得到氢氧化钠、氯气和氢气;
C、蒸发为物理变化;
D、加入过量的氯水能将I2氧化成更高价的化合物.
解答 解:A、溴元素在海水中以化合态存在,将元素由化合态转化为游离态时发生电子转移,所以一定发生氧化还原反应,生成溴单质然后,用有机萃取,故A错误;
B、钠易与水反应,电解饱和食盐水得到氢氧化钠、氯气和氢气,应用电解熔融的氯化钠的方法冶炼钠,故B错误;
C、蒸发是根据物质的沸点进行分离的操作,为物理变化,故C正确;
D、加入过量的氯水能将I2氧化成更高价的化合物,减少碘的产率,故D错误;
故选C.
点评 本题考查了海水资源的开发和利用,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,根据基本概念结合物质转化方式来分析解答,知道从海水中提取溴的方法,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
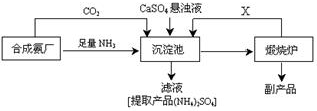
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{46}$Ti比${\;}_{22}^{47}$Ti少1个质子 | |
| B. | ${\;}_{22}^{46}$Ti和${\;}_{22}^{47}$Ti的化学性质相同 | |
| C. | ${\;}_{22}^{46}$Ti的相对原子质量是46 | |
| D. | ${\;}_{22}^{47}$Ti的原子序数为47 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 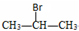 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | Y是第三周期第ⅡA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com