
【题目】某化学实验需要450mL0.10mol·L-1Na2CO3溶液,某同学选用Na2CO3·10H2O 晶体进行配制,简要回答下列问题:
(1)该实验应选择____mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为_____g。
(3)该实验的正确操作顺序是_____(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)下列操作对溶液浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度_____;
②配制过程中未洗涤烧杯和玻璃棒,会使浓度_____;
③NaOH溶解后未经冷却立即注入容量瓶至刻度线,会使浓度____;
④定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度_____。
【答案】500 14.3 A E F D C B 无影响 偏低 偏高 偏低
【解析】
(1)根据所配溶液体积选择相应容量瓶;
(2)计算溶质质量是需用按容量瓶规格进行计算;
(3)实验步骤为:称取-溶解-移液-洗涤-定容-摇匀等;
(4)误差分析时利用公式![]() 进行分析。
进行分析。
(1)实验室容量瓶规格有50mL、100mL、250mL、500mL、1000mL等,故配制450mL0.10mol·L-1Na2CO3溶液需要用500mL容量瓶。
故答案为:500;
(2)Na2CO3物质的量![]() ,则Na2CO3·10H2O的质量
,则Na2CO3·10H2O的质量![]() 。
。
故答案为:14.3;
(3)溶液配制实验步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以答案为A、E、F、D、C、B;
(4)①若容量瓶中有检漏时残留的少量蒸馏水,对溶液配制无影响;
②配制过程中未洗涤烧杯和玻璃棒则导致溶质物质的量n减小,![]() ,则浓度会偏低;
,则浓度会偏低;
③NaOH溶解后未经冷却立即注入容量瓶至刻度线,由于溶液的热胀冷缩,导致V偏小,![]() ,则浓度偏高;
,则浓度偏高;
④定容时若仰视则溶液体积V偏大,![]() ,则浓度会偏低。
,则浓度会偏低。
故答案为:无影响;偏低;偏高;偏低。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1)基态Cu原子的核外电子排布式为________;Cu、Zn的第二电离能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空间构型为________;与SO2互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br·2H2O中心离子配位数为_______
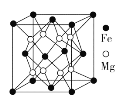
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞距离Mg原子最近Mg数目为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
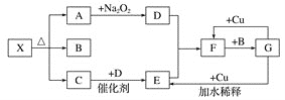
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量相等的CO和CO2中,同温同压下所占的体积比为____,原子个数之比为____。
(2)1.8g水与____mol硫酸所含的分子数相等,它们所含氧原子数之比是____,其中氢原子数之比是_____。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为_____。
(4)可用于分离或提纯物质的方法有:
A.过滤B.萃取C.渗析D.蒸馏E.灼热氧化F.分液。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠____;
②提取溴水中的溴单质_____;
③除去CuO中的Cu_____;
④除去水中的Na+、SO42-、Cl-等杂质_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水杨酸和阿司匹林互为同系物
B.H2 和 D2 互为同素异形体
C.甲苯分子中所有碳原子均共平面
D.分子式为 C3H6BrCl 和C3H6Br2的有机物的同分异构体个数相同(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。
(2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。
(3)如图是一个电解过程示意图。
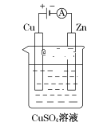
①锌片上发生的电极反应式是:____________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。

请回答:
(1) X中含有的非金属元素是________,写出X灼烧的化学方程式是_________________。
(2)向X的溶液中通入少量SO2,请写出离子方程式__________________。
II .某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(1)该兴趣小组所记录的实验现象说明铜与铁离子的反应__________(填有或没有)限度。
(2)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:___________________________________、_________________________________。
(3)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
①____________,②___________,③_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com