
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.

(1)写出实验室制取乙炔的化学方程式: ______.
(2)实验室制取乙炔时,分液漏斗中的液体 a通常是 ______.
(3)B溶液的作用是 ______.
(4)装置D中的现象是: ______.
(5)乙炔能否使溴的的四氯化碳溶液褪色?______(“能”或“不能”),若能写出完全反应原理_______________
(6)工业上常用乙炔、氯化氢等物质作原料来合成聚氯乙烯,请写出相关方程式 _______________
【答案】CaC2+2H2O→C2H2↑+Ca(OH)2 饱和食盐水 吸收杂质气体硫化氢 高锰酸钾溶液褪色 HC≡CH+2Br2→BrCH(Br)-(Br)CHBr CH≡CH+HCl![]() CH2=CHCl
CH2=CHCl 
【解析】
(1)实验室利用电石与水反应制取乙炔;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率;
(3)此反应中会产生杂质气体硫化氢,会对乙炔性质实验造成干扰,据此解答;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色;
(5)溴水与乙炔发生加成反应;
(6)聚氯乙烯的单体是氯乙烯,乙炔与氯化氢发生加成生成氯乙烯,氯乙烯发生加聚生成聚氯乙烯,据此写出反应的方程式。
(1)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为: CaC2+2H2O→C2H2↑+Ca(OH)2;
答案是: CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率;
答案是:饱和食盐水;
(3)此反应中会产生杂质气体硫化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢气体,以避免干扰后面乙炔性质的检验;
答案是:吸收杂质气体硫化氢;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应,使高锰酸钾溶液褪色;
答案是:高锰酸钾溶液褪色;
(5)溴水与乙炔发生加成反应,反应方程式为: HC≡CH+2Br2→BrCH(Br)-(Br)CHBr;
答案是: HC≡CH+2Br2→BrCH(Br)-(Br)CHBr;
(6)聚氯乙烯的单体是氯乙烯,因此乙炔与氯化氢(1:1)反应生成氯乙烯,然后氯乙烯发生加聚生成聚氯乙烯,反应的方程式为:CH≡CH+HCl![]() CH2=CHCl;
CH2=CHCl; ;
;
故答案是:CH≡CH+HCl![]() CH2=CHCl;
CH2=CHCl;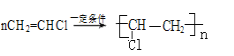 。
。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列关于反应“C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O”的说法正确的是
CO2↑+2SO2↑+2H2O”的说法正确的是
A. IL pH=2的H2SO4溶液中含有的H+数目为0.02NA
B. 含0.2molH2SO4的浓硫酸与足量炭充分反应生成气体分子总数为0.3NA
C. 生成SO24.48L(标况下)时转移电子数为0.4NA
D. 8.8gCO2中共用电子数目为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的离子晶体空间结构示意图。

(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式:A________,B________,C_________,D________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的空间结构。
①FeS2晶体中存在的化学键类型是 ________。
②若晶体结构A中相邻的阴、阳离子的最小距离为a cm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学–选修3:物质结构与性质)碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_____________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:________________。

(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Gr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式__________;CH3COOH分子中碳原子的杂化类型为___________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③铜铬合金的晶胞如图所示,已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为( )
A. 47B. 57C. 61D. 175
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池的回收利用可减少对环境的污染和实现铅资源的可持续发展,其阴、阳极填充物(铅膏,主要含PbO2、PbO、PbSO4)是废旧铅蓄电池的主要部分,回收铅单质的一种工艺流程如下:

(1)反应①的化学方程式为________________,操作a的名称是___________。
(2)滤液B中的溶质除Na2SO4外,还含有较多的___________(写化学式),若利用该滤液回收Na2SO4·10H2O,可加入___________(写试剂名称)除掉该物质。
(3)若反应②完成后的溶液中c(Pb2+)=5×10-6mol/L,则该溶液中c(SO42-)<___________ mol/L [已知Ksp(PbSO4)=1.06×10-8,Ksp (PbCO3)=3.3×10-14]
(4)用涂PbO2的钛板作阳极,铅板作阴极,电解含Pb2+的电解液,可得到纯度99.99%的Pb粉,产物Pb在___________极(填“阴”或“阳”)产生,阳极的电极反应式为___________。
(5)若实验中所取铅膏的质量为16g(PbO2的质量分数为15%),要将PbO2全部还原,至少需要加入1.0mol/L的Na2SO3溶液___________ mL(结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.标况下,11.2 L甲烷(CH4)和乙烯(C2H4)的混合气体中含氢原子的物质的量为2 mol
B.标况下,0.1 mol CCl4所占的体积为2.24 L
C.等质量的N2和CO含有的分子数均约为6.02×1023个
D.常温常压下,1 mol任何气体所占的体积均为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物乙二胺四乙酸铁钠( SaFeY)可溶于水,常见于铁强化盐中,回答下列问题:
实验1 制备乙二胺四乙酸铁钠晶体
实验原理:2Fe(OH)3+Na2CO3+2H4Y===2[NaFeY·3H2O]+CO2↑+H2O
实验步骤:①称取2.7 g FeCl3·6H2O于烧杯中溶解,分批次加入适量浓氨水,搅拌,过滤,洗涤,干燥。②将Fe(OH)3、乙二胺四乙酸(H4Y)、H2O加入三颈烧瓶(装置如下图),搅拌,80℃水浴反应1h,用Na2CO3溶液调节pH,经过一系列操作,过滤洗涤,晾干得到产品。

(1)“步骤①”为避免Fe(OH)3沉淀中裹入过多杂质,采取的措施有___________。
(2)判断“步骤①”中沉淀是否洗涤干净的操作为___________。
(3)若滴液漏斗替换为分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因为___________。
(4)“步骤②”中的“一系列操作”为___________(填标号),若将溶液直接蒸干,会造成___________。
A.蒸发浓缩,趁热结晶
B.蒸发浓缩至溶液表面出现晶膜,停止加热
C蒸发浓缩至大量晶体析出,停止加热
实验2市售铁强化盐中铁含量测定
已知:①铁强化盐含有NaCl、KIO3 、NaFeY,其中n(KIO3)︰n( NaFeY)=1︰50
②I2+2S2O32-===2I-+ S4O62-
称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,重复操作2~3次,消耗Na2S2O3标准液平均值为VmL。
(5)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________。
(6)滴定终点的现象为___________填颜色变化)。
(7)样品中铁元素的质量分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com