
下列有关焓变与反应热的说法,正确的是 ( )
A.反应热和焓变的单位都是kJ
B.如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等
C.如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等
D.任何化学反应的反应热均可通过实验直接测定
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.CO2的原子晶体和分子晶体互为同素异形体
B.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子跟两个C原子相结合
C.CO2的原子晶体和CO2的分子晶体具有相同的物理性质
D.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有一种;
写出的核外电子排布式_________。
 (2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)Ca0晶胞如右图所示,Ca0晶体中Ca2+的
配位数为________;Ca0的焰色反应为砖红色,许多
金属或它们的化合物都可以发生焰色反应,其原因
是________。
(4)由叠氮化钾(KN3)热分解可得纯 ,下列有关说法正
,下列有关说法正
确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:

将含0.0015mol 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol NaOH溶液25.00 mL,则该配离子的化学式为____________。
NaOH溶液25.00 mL,则该配离子的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是现代社会发展的三大基本问题之一,能源家族中:①煤炭、②核能、③石油、④天然气、⑤水能、⑥风能、⑦地热能等,属于不可再生的是________;属于新能源的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2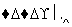 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2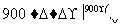 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是 ( )
 A.该过程中CeO2没有消耗
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
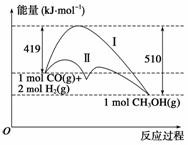
A.该反应的ΔH=91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
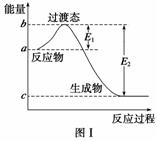

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为________________________________________________________________________。
(3)下表是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。
 (1)乙醇分子中官能团的名称是__________________。
(1)乙醇分子中官能团的名称是__________________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为
_____________________________________________,
反应类型是________________________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.2Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com