
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
| 2 |
| 5 |


科目:高中化学 来源: 题型:
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池的正极为锌 |
| B、电池正极反应式为:2MnO2+2e-+2H2O═2MnO (OH)+2OH- |
| C、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D、该电池反应中二氧化锰起催化剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
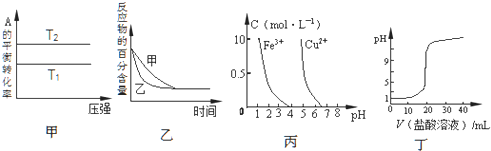
| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B、标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C、在常温常压下,3.4gNH3含有的电子数是2NA |
| D、含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| A、HPE不能跟浓溴水反应 |
| B、1molHPE最多可以和2mol NaOH反应 |
| C、HPE在核磁共振氢谱中有6个峰 |
| D、HPE分子中有2个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com