
| A. | 原子半径:K>Cl>Na | B. | 热稳定性:HF>H2O>PH3 | ||
| C. | 酸性强弱:HClO4>H2SO4>H3PO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
分析 A.电子层越多,原子半径越大,同周期从左向右原子半径减小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.金属性越强,对应碱的碱性越强.
解答 解:A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:K>Na>Cl,故A错误;
B.非金属性F>O>P,则热稳定性:HF>H2O>PH3,故B正确;
C.非金属性Cl>S>P,则酸性强弱:HClO4>H2SO4>H3PO4,故C正确;
D.金属性K>Na>Mg,则碱性强弱:KOH>NaOH>Mg(OH)2,故D正确;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有A1C13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | Se位于第4周期第ⅣA族 | B. | 原子半径:Br>Se>P | ||
| C. | 热稳定性:HCl>H2Se>HBr | D. | 酸性:HClO4>HBrO4>H2SeO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
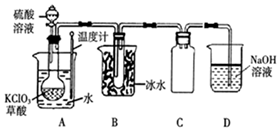 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “神舟十一号”宇宙飞船返回舱外表面主要是耐高温的新型无机非金属材料 | |
| C. | “天宮一号”是中国第一个空间实验室,其太阳能电池板的主要材料是二氧化硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| B. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA | |
| C. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| D. | 向大量水中通入1mol氯气,反应中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 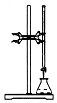 用标准氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. | 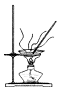 加热FeCl3溶液获取FeCl3固体 | |
| C. | 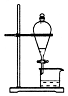 用酒精萃取碘水中的碘 | |
| D. | 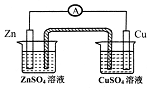 通过原电池原理证明金属性Zn>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )| A. | 每“呼出”22.4LCO2,转移电子数为$\frac{4}{3}$mol | |
| B. | “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C | |
| C. | “呼出”CO2时钠箔电极反应式是Na++e-=Na | |
| D. | 放电时电池总反应是4Na+3CO2=2Na2CO3+C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com