
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.分析 (1)利用铝与氢氧化钠反应生成偏铝酸钠与氢气证明;
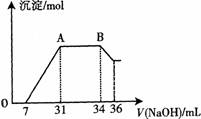
(2)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+,H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,结合方程式与原子守恒计算.
解答 解:(1)利用熔融物与氢氧化钠溶液反应生成,有气体生成说明含有Al,反应离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+、H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,
①由NH4++OH-=NH3+H2O可知,n(NH4+)=3×10-3 L×4 mol/L=0.012 mol,故还原产物NH4NO3的物质的量为0.012mol,
故答案为:0.012mol;
②由Al(OH)3+OH-=AlO2-+2H2O可知,n(Al3+)=n(Al)=n[Al(OH)3]=2×10-3 L×4 mol/L=0.008 mol,用于沉淀Al3+ 的NaOH为0.008mol×3=0.024 mol,
则n(Fe3+ )=n(Fe)=(0.024L×4 mol/L-0.024mol)×$\frac{1}{3}$=0.024 mol,
故答案为:0.008mol;0.024mol.
点评 本题以铝热反应为载体,考查物质组成的确定、离子共存、化学计算等,(2)中明确各阶段发生的反应是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
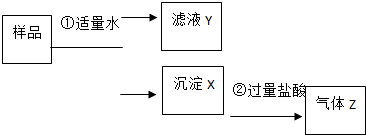 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
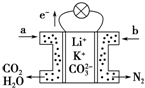 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为CH4,b为CO2 | |
| B. | CO32-向负极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
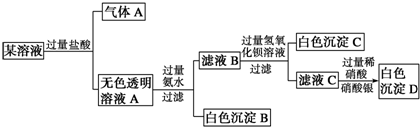
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
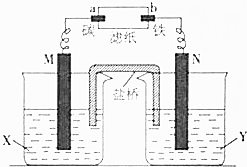 根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题:
根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:100:1011 | B. | 1:12:11 | C. | 14:12:11 | D. | 14:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com