
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
分析 A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
B.非金属性越强,电负性越大;
C.CO2、H2O、CH4、NH3分别为直线型(180°)、V型(104.5°)、正四面体(109°28′)、三角锥型(107°);
D.非金属性的半径越小,与H形成共价键的键能越大.
解答 解:A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则微粒半径:Li+<Na+<F-<O2-,故A错误;
B.非金属性越强,电负性越大,则电负性:F>O>N>C,故B错误;
C.CO2、H2O、CH4、NH3分别为直线型(180°)、V型(104.5°)、正四面体(109°28′)、三角锥型(107°),则分子中的键角:CO2>CH4>NH3>H2O,故C错误;
D.非金属性的半径越小,与H形成共价键的键能越大,则共价键的键能:H-F>H-Cl>H-Br>H-I,故D正确;
故选D.
点评 本题考查物质结构与性质,为高频考点,把握微粒半径半径方法、电负性与非金属性、共价键的键能、分子构型为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 氧化反应 | B. | 取代反应 | C. | 加成反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
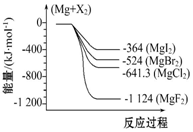 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
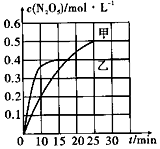 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com