
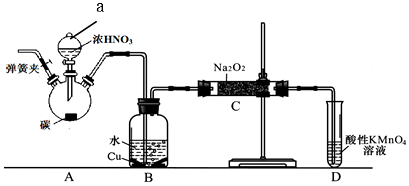
分析 装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
(1)根据装置图可知仪器a的名称,实验中的尾气NO,会污染空气,所以要加以吸收;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,过氧化钠与NO反应会生成NaNO2;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)①、二氧化碳会和过氧化钠发生的反应,对反应产生干扰,需要除去;
②、为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量,并据此计算隔夜熟肉中NaNO2的含量.
解答 解:(1)根据装置图可知仪器a的名称为分液漏斗,实验中的尾气NO,会污染空气,所以D装置的作用是除去未反应的NO,防止污染空气,
故答案为:分液漏斗;除去未反应的NO,防止污染空气;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)检验亚硝酸钠的实验设计为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠,或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,
故选b,
故答案为:b;
(4)①、为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
故答案为:碱石灰;
②.为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,
故答案为:打开弹簧夹,通入N2一段时间;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~2KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量为2.5×0.00500mol/L×16.00mL×10-3×69=13.8mg,所以隔夜熟肉中NaNO2的含量为13.8mg/kg,
故答案为:13.8.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ② | D. | 全都不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果5.6LN2含有n个氮分子,则NA一定约为4n | |
| B. | 18g水中所含的电子数是8NA | |
| C. | 在0.5mol/L的氯化钡溶液中含有离子数为1.5NA | |
| D. | 15gCH3+含有8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能$\frac{b-a+5.6c}{4}$ kJ•mol-1 | |
| D. | 1molP4含4molp-p键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com