
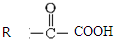 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ 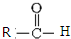 +CO2
+CO2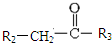 $\stackrel{NaOH(aq),△}{→}$
$\stackrel{NaOH(aq),△}{→}$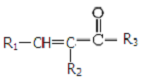 +H2O
+H2O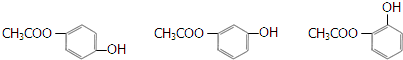 (其中之一).
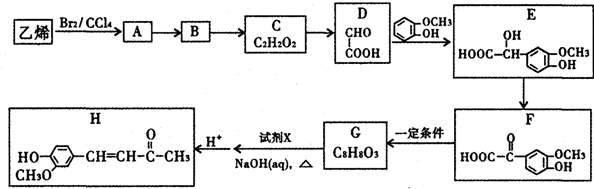
(其中之一).分析 根据题中各物质转化关系,乙烯与溴加成得A为BrCH2-CH2Br,B中只含有一种官能团,A碱性条件下水解得B为HOCH2-CH2OH,B发生氧化反应得C为OHCCHO,C氧化得D,D发生加成反应得E,E发生氧化反应得F,根据G的分子式可知,F发生信息①的反应得G为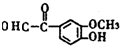 ,比较G和H的结构可知,G发生信息②中的反应得H,所以X为CH3COCH3,据此答题;
,比较G和H的结构可知,G发生信息②中的反应得H,所以X为CH3COCH3,据此答题;
解答 解:根据题中各物质转化关系,乙烯与溴加成得A为BrCH2-CH2Br,B中只含有一种官能团,A碱性条件下水解得B为HOCH2-CH2OH,B发生氧化反应得C为OHCCHO,C氧化得D,D发生加成反应得E,E发生氧化反应得F,根据G的分子式可知,F发生信息①的反应得G为 ,比较G和H的结构可知,G发生信息②中的反应得H,所以X为CH3COCH3,
,比较G和H的结构可知,G发生信息②中的反应得H,所以X为CH3COCH3,
(1)根据H的结构简式可知,②的分子式为C11H12O3,根据D的结构简式可知,D中含有官能团名称是 羧基、醛基,D→E的反应类型是加成反应,
故答案为:C11H12O3;羧基、醛基;加成;
(2)A→B反应的化学方程式为BrCH2-CH2Br+2NaOH $→_{△}^{H_{2}O}$ HOCH2-CH2OH+2NaBr,
故答案为:BrCH2-CH2Br+2NaOH $→_{△}^{H_{2}O}$ HOCH2-CH2OH+2NaBr;
(3)根据化合物F的结构简式,
A.F中有一个羧基,1molF最多能与1molNaHCO3反应,故A错误;
B.F中有酚羟基邻位碳上有氢原子,能与浓溴水发生取代反应,故B正确;
C.F中有一个苯环和一个羰基,在一定条件下,1molF最多能与4mol H2发生加成反应,故C错误;
D.F中有羧基和羟基,在一定条件下,能发生缩聚反应,故D正确;
故答案为:BD;
(4)与G互为同分异构体,且符合下列条件①苯环上只有两个取代基;②1mol该物质最多能与3mol氢氧化钠反应,③遇FeCl3溶液显紫色,说明有酚羟基,这样的有机物的结构简式为  ,
,
故答案为: (其中之一);
(其中之一);
(5)根据上面的分析可知,X的结构简式为CH3COCH3,
故答案为:CH3COCH3.
点评 本题考查有机推断与性质,题目难度中等,根据制备流程明确合成原理为解答关键,注意熟练掌握常见有机物结构与性质,明确常见反应条件、反应原理及反应类型,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
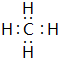 、
、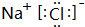
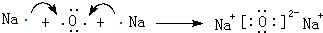 、
、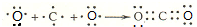
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
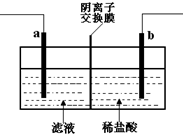 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
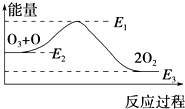 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
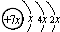 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: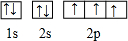
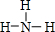 ,其中心原子D的杂化方式为sp3.
,其中心原子D的杂化方式为sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com