
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol
B.0.25mol
C.0.3mol
D.0.35mol
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】碘化钡(BaI2·2H2O)是一种白色粉末,常用于制取其他含碘化合物。一种制备流程如下:

(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有 (填序号)。
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉)∶n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为 ;用pH试纸测定溶液pH的方法是 。
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是 ;步骤V加入活性炭的目的是 。
(4)从过滤2所得滤液中获得BaI2·2H2O(溶解度曲线如右图所示)的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的工艺流程如下:

已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。
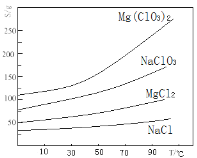
(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;② ;③ ;④过滤、洗涤。
(3)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。此过程中反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定步骤2中多余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4: ,平均消耗K2Cr2O7 溶液15.00 mL。
①题中所用FeSO4溶液中,常加入适量稀硫酸和铁粉以抑制其变质。其中,加稀硫酸的作用是(用离子方程式解释): 。
②步骤4中空缺的内容为 。
③产品中Mg(ClO3)2·6H2O(摩尔质量为299g/mol)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、对于数以万计的化学物质和化学反应,分类法的作用几乎是无可替代的。
(1)现有下列5种物质:CuO、CO、MgO、Na2O、FeO。按照不同的分类标准,它们中有1种物质与其他4种物质有明显的不同,找出这种物质,并写出依据(写出两种):
①______________________________;
②______________________________。
(2)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,用简单的图示方法表示二者之间的关系_______________________。
(3)生活中的食醋和豆浆分别属于分散系中的___________和___________,用___________可以鉴别(填化学专用名词)。
II、下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:

(1) 分类标准代号A表示______________(可多项)
a.两物质都是非电解质 b.两物质都易溶于水
c.两物质都是含碳化合物 d.两物质都是氧化物
(2) 上述五种物质中的某一物质的饱和溶液中通入足量CO2,溶液中会有晶体析出。该反应的离子方程式为:____________________ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是
A.海水中含有溴元素,需经过化学变化才可以得到溴单质
B.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
C.从海水中可以得到NaCl电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2→MgCl2(熔解)
MgCl2溶液→MgCl2→MgCl2(熔解)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如图所示实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
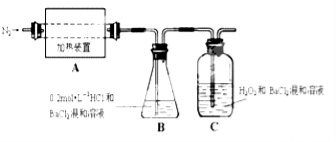
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液
B.稀硫酸
C.浓盐酸
D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3A12O3
27H2O↑+10MgO+3A12O3
(1)写出该化合物作阻燃剂的两条依据____________________________________。
(2)用离子方程式表示除去固体产物中A12O3的原理________________________。
II.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
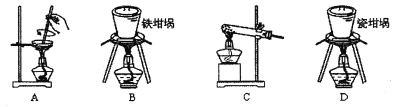
(1)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_______(填选项编号)。
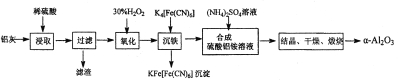
(2)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为____________________。
(3)若用调节溶液的pH“沉铁”,则得到Fe(OH)3,己知:
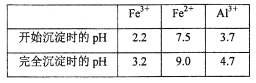
为保证产品的纯度,最好选用下列物质中的_______调节pH(填字母),调节pH的范围为_____。
a.A12O3
B.H2SO4
C.NaOH
D.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置。
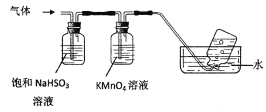
①集气瓶中收集到的气体是_____________________(填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com