


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
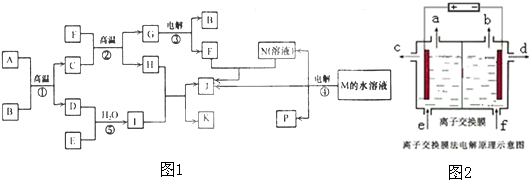
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源:2014届海南省琼海市高二下教学质量监测二化学卷(解析版) 题型:实验题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
P H=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08温州市八校联考)常温下,将V1 mLc1mol/L的醋酸滴加到V2 mLc2mol/L的氢氧化钠溶液中,下列结论正确的是()
A.若c1?V1=c2?V2 ,则混合液中c(CH3COO-)=c(Na+)
B.若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+)
C.若混合液的pH=7,则混合液中c1V1>c2V2
D.若混合液的pH>7,且V1=V2,则一定有c1<c2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com