
| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
| A. | A的转化率为:甲<丙<乙<丁 | B. | A的转化率为:甲<乙<丙<丁 | ||
| C. | B的转化率为:甲>丙>乙>丁 | D. | B的转化率为:丁>乙>丙>甲 |
分析 甲相当于在乙的基础上再增加A的物质的量,所以甲中B的转化率大于乙中B的转化率,但A的转化率要小于乙中A的转化率;
丁相当于在乙的基础上再增加B的物质的量,所以丁中A的转化率大于乙中A的转化率,但B的转化率要小于乙中B的转化率;
丙和乙相比,相当于在增大压强,平衡向逆反应方向移动,所以转化率均降低;
丙和甲相比,相当于在甲的基础上再增加B的物质的量,所以丙中A的转化率大于甲中A的转化率,但B的转化率要小于甲中B的转化率;
丙和丁相比,相当于在丁的基础上再增加A的物质的量,所以丙中B的转化率大于丁中B的转化率,但A的转化率要小于丁中A的转化率.
解答 解:将起始时情况作如下排列:
2A(g)+B(g)?3C(g)+2D(g)
甲 2 mol 1 mol
乙 1 mol 1 mol
丙 2 mol 2 mol
丁 1 mol 2 mol
A越少B越多,A的转化率越高,则A转化率最高的为丁,最低的为甲;乙与丙相比较,丙相当于在乙的基础上再分别增加1 mol A和1 mol B,因是恒容为加压,平衡逆向移动使A的转化率减小,故A的转化率丁>乙>丙>甲,同理得B的转化率:甲>乙>丙>丁;
故选:A.
点评 本题考查影响化学平衡移动的因素,题目难度中等,注意对比四种容器内各物质的物质的量关系,结合影响平衡移动的因素解答.


科目:高中化学 来源: 题型:选择题
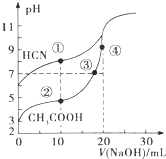
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2+SO2+2H2O═H2SO4+2HBr | B. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | ||
| C. | 4NH3+5O2═4NO+6H2O | D. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
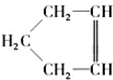 ,可简写为
,可简写为 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为 .
. .(任选一种)
.(任选一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大C的量,H2O的转化率增大 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 加入催化剂,平衡常数不变 | |
| D. | 升高温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是由玻璃纤维和合成树脂组成的材料 | |
| B. | 碳纤维增强复合材料具有韧性好,强度高而质轻的特点 | |
| C. | 硅酸盐材料是新型无机非金属材料 | |
| D. | 有机合成材料易老化,不耐高温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com