
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18g重水(D2O)所含的电子数为10NA
B. 常温常压下,0.3molNO2完全与水反应,转移的电子数为0.2NA
C. 标准状况下,22.4LCCl4中含有NA个CCl4分子
D. 常温下, 1L0.1mol/LCH3COONH4溶液中NH4+离子数为0.1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
废电池造成污染的问题日益受到关注。下列有关电池的说法正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 弱电解质在水中的电离程度报小,不能用作电池的电解质溶液
C. 原电池是将化学能完全转变为电能的装置
D. 回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质制备的说法中正确的是( )
A. 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体
B. 可用Na从TiCl4的水溶液中生产Ti
C. 工业上利用氯气和石灰水反应生产漂白粉和漂粉精
D. 可用石英、石灰石、纯碱在高温下生产玻璃
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:选择题
若NA表示阿伏伽德罗常数的值,下列说法正确的是
A. 1L 1mol·L-1的NaClO溶液中含有ClO-的数目为NA
B. 78g苯中含有C=C键的数目为3NA
C. 7.8gNa2O2固体中含有的离子总数为0.3NA
D. 标准状况下,将分子总数为NA的NO和O2充分混合后,所得混合气体的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
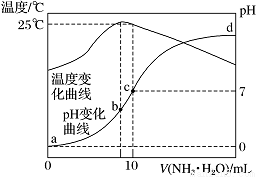
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=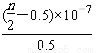
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
下列化学方程式书写正确的是( )
A. 
B. 
C. 
D. CH3COOH+CH3CH2OH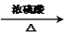 CH3COOCH3CH2+H2O
CH3COOCH3CH2+H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三第三次联考理综化学试卷(解析版) 题型:填空题
铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____区。基态Al原子的L层电子排布图为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________,1mol乙酸分子中含有的σ键的数目为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____。碳、硼、氮元素的电负性由大到小的顺序是_____。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____g·cm-3(设阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:选择题
甲醇脱氢可制取甲醛:CH3OH(g) HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是( )
HCHO(g)+ H2(g), 甲醇的平衡转化率随温度变化的曲线如右图所示(已知反应在IL 的密闭容器中进行)。下列有关说法正确的是( )
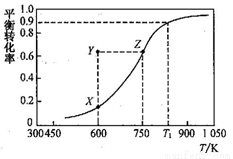
A. 平衡常数:K600K<K750K
B. 从Y到Z点可通过增大压强实现
C. 在TlK时,该反应的平衡常数为8.1
D. 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com