
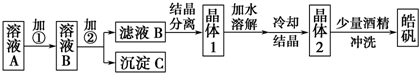
分析 由题意可知溶液A含有亚铁离子、锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,应先要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,加入的氧化剂不能引入新的杂质,通常用20%的H2O2 然后加入ZnO[ZnCO3或Zn(OH)2)]以调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质,过滤后将滤液进行蒸发浓缩、冷却结晶可得到ZnSO4•7H2O,洗涤晶体时,为避免晶体溶解,可用酒精进行洗涤,以此解答该题.
解答 解:由题意可知溶液A含有亚铁离子、锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,应先要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,加入的氧化剂不能引入新的杂质,通常用20%的H2O2 然后加入ZnO[ZnCO3或Zn(OH)2)]以调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质,过滤后将滤液进行蒸发浓缩、冷却结晶可得到ZnSO4•7H2O,洗涤晶体时,为避免晶体溶解,可用酒精进行洗涤,
(1)由以上分析可知试剂①应为过氧化氢,可将制氢废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质,
故答案为:20%的H2O2;将制氢废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质;
(2)试剂②是用来调节溶液PH到至3.7-5.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到至3.7-5.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子,
故答案为:bcd;
(3)晶体溶解再结晶是提纯晶体的方法为重结晶,故答案为:重结晶;
(4)涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率,
故答案为:为了冲洗掉晶体表面的杂质离子,防止晶体溶解,影响产率.
点评 本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
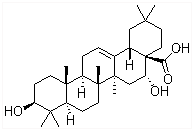 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
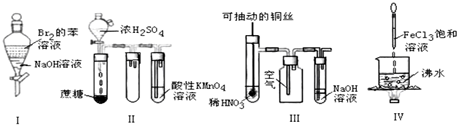
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
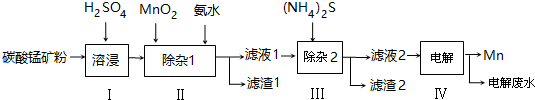
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com