
| A. | H2SO4(浓) | B. | O3 | C. | Ca(ClO)2 | D. | SO2 |
科目:高中化学 来源: 题型:填空题
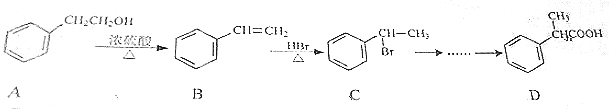
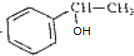
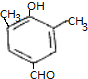 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 二氧化锰 | D. | 硫酸铜 氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
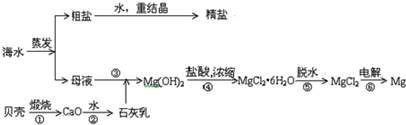
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 下列转化均能一步实现:粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| C. | 硬度:晶体硅<金刚石 | |
| D. | 高温下用焦炭还原SiO2制取粗硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com