
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
分析 由元素在周期表中位置可知,X处于第二周期,M、Y、Z处于第三周期.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.若W为Al时,则X为C、Y为Si、Z为P,非金属性越强,最高价氧化物对应水化物的酸性越强;
C.若形成简单离子,四种只能为金属元素,M为Na、X为Be、Y为Mg、Z为Al,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.M为Na时,X为Be、Y为Mg,均为金属元素.
解答 解:由元素在周期表中位置可知,X处于第二周期,M、Y、Z处于第三周期.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:M>Y>Z>X,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,若W为Al、X为C、Y为Si、Z为P时,最高价含氧酸的酸性:磷酸>碳酸>硅酸>偏铝酸,故B错误;
C.若形成简单离子,四种只能为金属元素,M为Na、X为Be、Y为Mg、Z为Al,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Na+>Mg2+>Al3+>Be2+,故C正确;
D.M为Na时,X为Be、Y为Mg,均为金属元素,故D错误,
故选C.
点评 本题考查位置与性质关系,需要学生熟练掌握元素周期表,注意元素的不确定性,利用列举法解答,难度中等.


科目:高中化学 来源: 题型:解答题
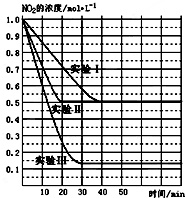 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
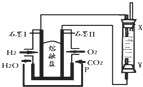 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
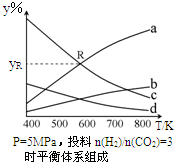 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:推断题
[化学——选修5:有机化学基础]抗疟新药青蒿素的结构简式如下图所示。
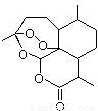
(1)青蒿素的分子式为____。
(2)为了引入过氧基(-O-O-),需要在有机合成中引入羟基,引入羟基的反应类型有____。(选填编号)
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应
天然香草醛(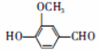 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
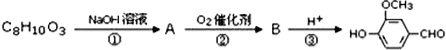
(3)M的结构简式为____。
(4)步骤①③的作用是____。
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的结构简式____。
①苯环二取代;②能水解;③能发生银镜反应;④与FeCl3溶液发生显色反应。
(6)苄基乙醛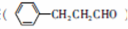 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
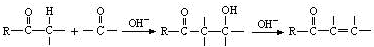
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com